
A、 分离碘酒中的碘和酒精 |
B、 实验室制氨气 |
C、 除去Cl2中的HCl |
D、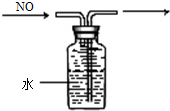 排水集气法收集NO |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 实 验 | 解 释 或 实 验 结 论 |
| (1)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g. | (1)A的分子式为: |
| (2)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (2)写出A中所含有的官能团名称: |
(3)A的核磁共振氢谱如图: |
(3)A中含有 |
| (4)综上所述,A的结构简式(含甲基) | |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有位于周期表前四周期的A、B、C、D、E、F六种元素,其原子序数依次增大.已知A原子核外有三个未成对电子;A与B形成的一种化合物常温下是红棕色气体;化合物C2E的晶体为离子晶体;D单质的熔点在同周期单质中最高;E原子核外的M层中只有两对成对电子;F原子核外最外层电子数与C相同,其余各层均充满.请根据以上信息,回答下列问题:
有位于周期表前四周期的A、B、C、D、E、F六种元素,其原子序数依次增大.已知A原子核外有三个未成对电子;A与B形成的一种化合物常温下是红棕色气体;化合物C2E的晶体为离子晶体;D单质的熔点在同周期单质中最高;E原子核外的M层中只有两对成对电子;F原子核外最外层电子数与C相同,其余各层均充满.请根据以上信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4 L Cl2中含有NA个Cl2分子 |
| B、标准状况下,22.4L CCl4中含有的CCl4分子数为NA |
| C、1.0 L 浓度为18mol?L-1H2SO4溶液与足量的铜片加热条件下反应,被还原的H2SO4的分子数为9NA |
| D、一定条件下,2.3gNa完全与O2反应生成3.6g产物时失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+ K+ SO42- NO3- |
| B、Mg2+ NH4+ SO42- Cl- |
| C、Na+ K+ SO42- NO3- |
| D、K+ Na+ MnO4- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池的负极是电子流出的一极,电极上发生氧化反应 |
| B、原电池反应一定是释放能量的置换反应 |
| C、电解可以使通常条件下不能发生的氧化还原反应得以发生 |
| D、电解池中,连接电源正极的一极叫阳极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、①②③ |
| C、③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn为负极,MnO2为正极 |
| B、MnO2为正极,Zn为负极 |
| C、工作时电子由MnO2经外电路流向Zn极 |
| D、Zn电极发生还原反应,MnO2电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com