
【题目】t℃时,将3 mol A 和1 mol B气体,通入体积为2L的密闭容器(容积不变),发生反应:3A(g) + B(g)![]() 4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白:
4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白:
(1)从反应开始到达到平衡状态,生成C的平均反应速率为_________________。
(2)达到平衡状态时, B 物质的转化率α(B) = _____________,平衡常数K= __________________(填计算结果)。
(3)若继续向原混和物质通入少量氦气后(设氦气不与A、B、C反应),化学平衡_________
A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动
(4)若向原平衡中再充入a mol C,在t℃时达到新平衡,此时B的物质的量为:n (B) = ________________ mol.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间该满足的关系为:_________________________。
【答案】
(1)0.2 mol/L.min
(2)20% 1/27![]()
(3)C
(4)0.8+0.2a
(5)n(A)/n(B)=3:1,n(C)为任意值
【解析】
试题分析:(1)平衡时C的浓度为0.4mol/L,依据化学反应速率概念计算得到:C的反应速率=![]() =0.2mol/Lmin;
=0.2mol/Lmin;
(2)t℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)![]() xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8mol B,并测得C的浓度为0.4mol/L物质的量为0.8mol,
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8mol B,并测得C的浓度为0.4mol/L物质的量为0.8mol,
3A(g)+B(g)![]() xC(g),
xC(g),
起始量(mol) 3 1 0
变化量(mol) 0.6 0.2 0.8
平衡量(mol) 2.4 0.8 0.8
1:x=0.2:0.8=1:4,x=4
平衡浓度c(A)=![]() =1.2mol/L,c(B)=0.4mol/L,c(C)=0.4mol/L;α(B) =
=1.2mol/L,c(B)=0.4mol/L,c(C)=0.4mol/L;α(B) =![]() ×100%=20%;
×100%=20%;
平衡常数K=![]() =
=![]() ;
;
(3)恒温恒容容器中加入氦气是惰性气体,增大体系压强,各气体分压不变,平衡不变,故答案为C;
(4)若向原平衡混合物的容器中再充入a mol C,在t℃时达到新的平衡,反应前后气体体积不变,加入C增大压强,平衡不动;反应物的转化率不变,加入amolC,相当于AB的起始量为amol,![]() amol,依据(2)可知AB的转化率为20%,B反应物质的量
amol,依据(2)可知AB的转化率为20%,B反应物质的量![]() amol×20%=0.05amol,生成C0.2amol,则此时B的物质的量为n(B)=0.8+0.2a;
amol×20%=0.05amol,生成C0.2amol,则此时B的物质的量为n(B)=0.8+0.2a;
(5)在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C),转化为起始量和原平衡相同;
3A(g)+B(g)![]() 4C(g)
4C(g)
3 1 0
n(A) n(B) n(C)
n(A)+![]() n(C) n(B)+
n(C) n(B)+![]() n(C) 0
n(C) 0
n(A)+![]() n(C)=3
n(C)=3
n(B)+![]() n(C)=1
n(C)=1
n(A)=3n(B),n(C)>0或n(A)+![]() n(C)=3[n(B)+
n(C)=3[n(B)+![]() n(C)]。
n(C)]。


科目:高中化学 来源: 题型:
【题目】(1)2,6-二甲基-4-乙基庚烷的结构简式是______________________,其一氯代物有_________种。
(2)按系统命名法下列有机物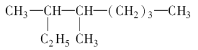 的名称是______________。
的名称是______________。
(3)某化合物的分子式为C5H11Cl,其核磁共振氢谱图中显示三种峰且面积之比为6:4:1,则该物质的结构简式为______ _;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是( )
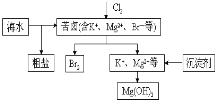
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,一定条件下 Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为: Fe2O3(s)+3CH4(g) ![]() 2Fe(s)+3CO(g)+6H2(g)
2Fe(s)+3CO(g)+6H2(g)
(1)反应在5 L的密闭容器中进行,2 min 后达到平衡,测得 Fe2O3在反应中质量减少 4.8 g。则该段时间内H2的平均反应速率为______________;
(2)将固定质量的 Fe2O3(s)和 CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是______________;
A.CH4的转化率等于 CO的产率
B.混合气体的平均相对分子质量不变
C.v 正(CO): v 逆(H2)=1 : 2
D.固体的总质量不变
(3)FeO 可用CO进行还原,已知:t℃时,FeO(s)+CO(g) ![]() Fe(s)+CO2(g) K=0.5
Fe(s)+CO2(g) K=0.5
若在 1 L密闭容器中加入0.04 mol FeO(s),并通入 x mol CO,t℃时反应达到平衡。此时FeO(s)的转化率为 50%,则x=______________。
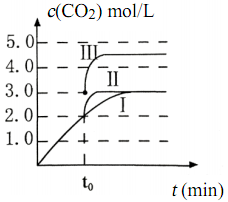
(4)在 3 L容积可变的密闭容器中发生反应:FeO(s)+CO(g) ![]() Fe(s)+CO2(g),c(CO2)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件, 曲线 I变为曲线II和曲线III。当曲线I变为曲线 II时,改变的条件是______________。当通过改变压强使曲线 I变为曲线III时,曲线 III达到平衡时容器的体积为_________L。
Fe(s)+CO2(g),c(CO2)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件, 曲线 I变为曲线II和曲线III。当曲线I变为曲线 II时,改变的条件是______________。当通过改变压强使曲线 I变为曲线III时,曲线 III达到平衡时容器的体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol![]() L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH______0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______ mol![]() L1,此时溶液中c(CrO42)等于__________ mol
L1,此时溶液中c(CrO42)等于__________ mol![]() L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72还原成Cr3+,该反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol·L–1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径的大小W<X<Y
B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态
D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是

A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D.pH=7的溶液中:c(Na+)>2c(C2O42–)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢 (H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
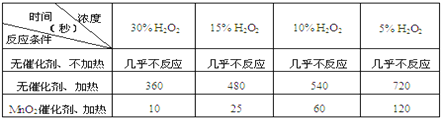
①该研究小组在设计方案时。考虑了浓度、 、 等因素对过氧化氢分解速率的影响
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响? 。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:

①写出H2O2发生反应的化学反应方程式 。
②.实验结果说明催化剂作用的大小与 有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为验证元素周期表中元素性质的递变规律,利用右图装置可验证同主族非金属性的变化规律。设计了如下系列实验。
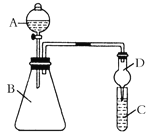
(1)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____________________________________________。
(2)仪器A的名称为____________________,
(3)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4, (KMnO4 与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到混合溶液 的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用______________溶液吸收尾气。
(4)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3,C中加Na2SiO3 溶液观察到C中溶液_____________的现象,即可证明。但有的同学认为盐酸具有挥发性,应用__________溶液除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com