
下列有关实验装置进行的相应实验,能达到实验目的的是
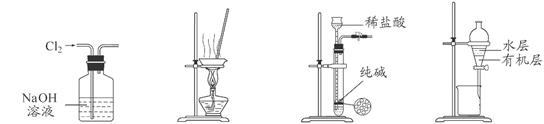
图1 图2 图3 图4
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
科目:高中化学 来源: 题型:
Ⅰ:请将所选下列物质的转化或分离方法的序号填在横线上(每一项只填写一种方法)。
①溶解 ②裂解 ③分馏 ④裂化 ⑤干馏 ⑥蒸馏 ⑦电解
⑧过滤 ⑨萃取
(1)把煤转化为焦炉气、煤焦油和焦炭等 。
(2)从原油中分离出汽油、煤油、柴油等 。
(3)将重油转化为汽油 。
(4)将海水淡化 。
(5)从海水得到的无水MgC12中提取金属镁 。
Ⅱ: 下图所示为某化学兴趣小组设计的乙醇催化氧化及其产物检验的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。

图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水CuSO4粉末,D为碱石灰, F为新制的氢氧化铜悬浊液
已知: 含—CHO的物质在加热条件下与新制的Cu(OH)2悬浊液反应生成砖红色沉淀.
(1)在上述装置中,实验时需要加热的仪器为(填仪器或某部位的代号) 。
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是_____________。
D处使用碱石灰的作是 。
(3) E处是一种纯净物,其反应方程式为 。
(4)写出乙醇发生催化氧化的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
a、b、c、d、e四种短周期元素的原子序数逐渐增大。a为非金属元素,且a、e同主族,c、d为同周期的相邻元素。e原子的质子数等于c、d原子最外层电子数之和。b原子最外层电子数是内层电子数的2倍。c的氢化物分子中有3个共价键。试推断:
(1)写出b元素在周期表中的位置 ;
(2)有a、c、d所形成的离子化合物是 (写化学式)它与e的最高价氧化物对应水化物的
溶液加热时反应的离子方程式是 ;
(3)c的单质的电子式为 。
(4)b和d相比,非金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (选填字母序号)。
A.常温下,b的单质呈固态,d的单质呈气态 B.d的氢化物的稳定性强于b的氢化物
C.b与d形成的化合物中,b呈正价 D.d的氢化物的沸点高于b的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L。则原混合物中单质铁的质量是
A.2.24g B.3.36g C.5.60g D.10.08g
查看答案和解析>>
科目:高中化学 来源: 题型:
在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
 图中: ①为氯气发生装置;②的试管里盛有15mL 30% KOH 溶液.并置于热水浴中; ③的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④的试管里加有紫色石蕊试液; ⑤为尾气吸收装置。
图中: ①为氯气发生装置;②的试管里盛有15mL 30% KOH 溶液.并置于热水浴中; ③的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④的试管里加有紫色石蕊试液; ⑤为尾气吸收装置。
请填写下列空白:
⑴制取氯气时,在烧瓶里加入一定量的二氧化锰,通过______(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
 A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
⑵比较制取氯酸钾和次氯酸钠的条件.二者的差异是 。反应完毕经冷却后,②的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验操作名称)。
(3)本实验中制取次氯酸钠的离子方程式是: 。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______________________________________ |
| 然后溶液从无色逐渐变为 色 | _________________________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表中信息判断,下列选项不正确的是
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO | Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
 A.
A.  与Br2发生1:1加成反应的产物有5种
与Br2发生1:1加成反应的产物有5种
B.除去苯中 的方法:加溴水,充分振荡,静置分液。
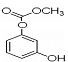 |
C. 1mol 最多能与4mol氢氧化钠反应。
D.采用分子筛固体酸作为苯和丙烯反应的催化剂来制备异丙苯,符合绿色化学工艺。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且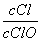 的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
A.若某温度下,反应后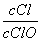 =11,则溶液中
=11,则溶液中 =
=
B.参加反应的氯气的物质的量等于 a mol
a mol
C.改变温度,反应中转移电子的物质的量ne的范围: a mol≤ne≤
a mol≤ne≤ a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为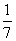 a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
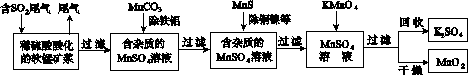
请回答下列问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
A.废弃物的综合利用
B.白色污染的减少
C.酸雨的减少
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原因是________________________________。
(3)已知:25 ℃、101 kPa时,
Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ/mol
S(s)+O2(g)===SO2(g) ΔH=-297 kJ/mol
Mn(s)+S(s)+2O2(g)===MnSO4(s)
ΔH=-1065 kJ/mol
SO2与MnO2反应生成无水MnSO4的热化方程式是____________________________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是________________________________。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是________________。
(6)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2________kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com