
 为了节能减排、缓解能源短缺,我国大力开发甲醇等可再生的新能源.工业上根据CO(g)+2H2(g)═CH3OH(g)△H合成甲醇.
为了节能减排、缓解能源短缺,我国大力开发甲醇等可再生的新能源.工业上根据CO(g)+2H2(g)═CH3OH(g)△H合成甲醇.| c(CH 3OH) |
| c(CO)?c2(H 2) |
| c(CH 3OH) |
| c(CO)?c2(H 2) |
| 0.8mol/L |
| 5min |
| 0.4mol/L |
| 0.5mol/L |
| 9.2g |
| 32g/mol |


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
| A、葡萄糖银镜反应实验后的试管内壁附有银,可用氨水清洗 |
| B、酸碱中和滴定时,未用待测液润洗锥形瓶,对测定结果无影响 |
| C、向某溶液中加入足量盐酸无现象,再加入BaCl2溶液生成白色沉淀说明有SO42- |
| D、在无色溶液中先加入氯水、再加入CCl4,振荡静置,下层溶液显红棕色说明有Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
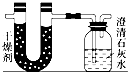 已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):
已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (澄清石灰水+广口瓶)的质量 | 312.0g | 314.2g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com