
| A. | 该反应的速率主要①决定 | B. | HClI是该反应的催化剂 | ||
| C. | v(H2)=v(HCl)=v(I2) | D. | a值越小,该反应速率越快 |
分析 A.化学反应的反应速率取决于反应速率最慢的反应;
B.催化剂在最初的反应中参加反应、在最终的反应中生成;
C.同一可逆反应中,反应速率之比等于其计量数之比;
D.反应速率v越小,说明该反应越慢.
解答 解:A.化学反应的反应速率取决于反应速率最慢的反应,所以该反应的速率主要由①决定,故A正确;
B.催化剂在最初的反应中参加反应、在最终的反应中生成,HClI先生成后参加反应,所以不能催化剂,故B错误;
C.同一可逆反应中,反应速率之比等于其计量数之比,该反应方程式为H2(g)+2ICl(g)=2HCl(g)+I2,所以反应速率2v(H2)=v(HCl)=2v(I2),故C错误;
D.反应速率v越小,说明该反应越慢,故D错误.
故选A.
点评 本题考查化学反应机理,侧重考查学生分析判断能力,涉及反应速率快慢判断、决定因素及催化剂等知识点,易错选项是A,题目难度中等.


科目:高中化学 来源: 题型:解答题
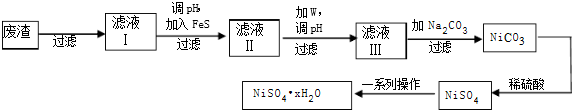
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基可以电离成H+和O2- | B. | 1mol羟基共有9mol电子 | ||
| C. | 与氢氧根离子是类别异构 | D. | 羟基只存在于分子晶体中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制1.001.00mol•L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中 | |
| B. | 在50mL量筒中配制0.100 0moL•L-1碳酸钠溶液 | |
| C. | 只有100mL容量瓶、烧杯、玻璃棒、胶头滴管(非玻璃仪器任选),用pH=1的盐酸无法配制100mLpH=2的盐酸 | |
| D. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2CO3 | Ka1=4.3×10-7 | HClO | Ka=2.95×10-8 |
| Ka2=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由小到大的顺序为:rW<rZ<rY | |
| B. | 简单离子氢化物的热稳定性Z>Y | |
| C. | X2W的沸点高于X2Z | |
| D. | 只含X、Y、W三种元素的化合物,不可能是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧原子能量最高的电子的电子云图: | |
| B. | 35Cl与37Cl互为同素异形体 | |
| C. | CH4分子的比例模型: | |
| D. | 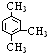 的命名:1,3,4-三甲苯 的命名:1,3,4-三甲苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com