
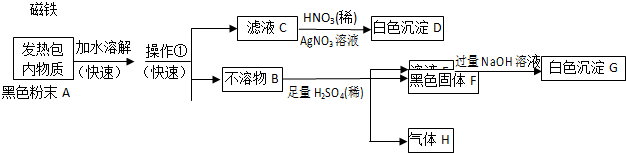


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
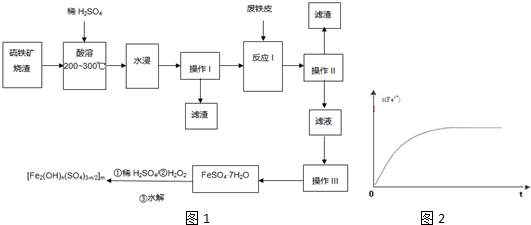
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃着的酒精灯不慎碰翻失火,应该迅速用湿抹布扑盖 |
| B、用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量 |
| C、制备摩尔盐的过程中,洗涤硫酸亚铁铵晶体时,应用少量酒精洗去晶体表面附着的水分 |
| D、在适量氯化钴的乙醇溶液中,逐滴加入水至溶液恰好呈粉红色,加热该溶液,结果依次呈现紫色、蓝紫色、蓝色的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20% | B、25% |
| C、80% | D、85% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将3-4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
| B、在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 |
| C、在试管中将一定量的浓硝酸,浓硫酸和苯混合,用酒精灯直接加热几分钟,即可制得硝基苯 |
| D、溶质的溶解度越大,溶液的浓度越高,溶剂的蒸发速度越快,溶液的冷却速度越快,析出的晶体就越细小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
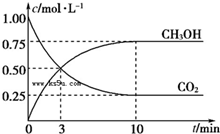 已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )| A、欲增大平衡状态时c(CH3OH)/c(CO2)的比值,可采用升高温度的方法 |
| B、3 min时,CO2的消耗速率等于CH3OH的生成速率,且二者浓度相同 |
| C、欲提高H2的平衡转化率只能减小反应容器的体积 |
| D、从反应开始到平衡,CO2的平均反应速率v(CO2)=0.025 mol?L-1?min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com