
| A、石灰石 |
| B、Ca(OH)2 |
| C、CaCO3 |
| D、CaO |


科目:高中化学 来源: 题型:
| A、c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]<c(NH4Cl) |
| B、中和相同体积、相同pH的①硫酸、②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 |
| C、0.2 mol?L-1 HCl溶液与等体积0.05 mol?L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| D、已知难溶物FeS的Ksp=8.1×10-17,FeS饱和溶液中c(H+)2?c(S2-)=1.0×10-22,为使溶液里c(Fe2+)达到了1mol?L-1,应调节溶液中的c(H+)为1.11×10-3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
2- 4 |
| 实验序号 | 硫酸体积 | NaOH溶液体积 | NaOH溶液浓度 |
| ① | 5.00mL | 35.65mL | 5.00mol?L-1 |
| ② | 5.00mL | 39.65mL | 5.00mol?L-1 |
| ③ | 5.00mL | 35.55mL | 5.00mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅烷的分子通式可表示为SinH2n+2 |
| B、甲硅烷的稳定性比甲烷强 |
| C、甲硅烷的沸点高于甲烷 |
| D、甲硅烷燃烧生成SiO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内压强不随时间的变化而变化 |
| B、容器内A、B、C、D四者共存 |
| C、A、D的消耗速率相等 |
| D、C、D的生成速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Cl2光照 |
| ① |
| NaOH溶液 |
| ② |
| Cu、O2、加热 |
| ③ |
| 银氨溶液加热、酸化 |
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.金属钠与氧气反应,条件不同产物不同 |
| B、钠着火时可用水扑灭 |
| C、将钠保存在汽油中 |
| D、金属钠的化学性质活泼,可从硫酸铜溶液中置换出金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
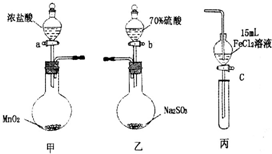 为验证氧化性C12>Fe3+>SO2某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).
为验证氧化性C12>Fe3+>SO2某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).| 步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |||
| Ⅰ | 既有Fe3+又有Fe2+ | 有SO
| ||
| Ⅱ | 有Fe3+无Fe2+ | 有SO
| ||
| Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠与硫酸锌溶液反应置换出金属锌 |
| B、金属铁与硫酸溶液反应后所得溶液质量比原溶液的质量大 |
| C、在常温下,铝比镁更容易与氧气反应 |
| D、金属铜与氯化银反应得到金属银 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com