
【题目】工业上可以从电解铜的阳极泥中提取很多重要物质,其工艺流程如下:
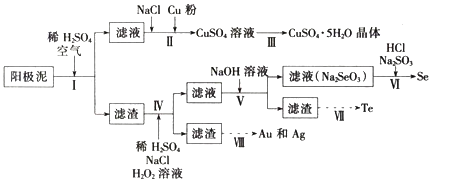
已知:①阳极泥的主要化学成分,如表所示:
主要成分 | Cu Ag Au Se Te |
百分含量/% | 23.4 12.1 0.9 6.7 3.1 |
②温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表所示:
固定浸出温度 | 固定H2SO4浓度 | |||
H2SO4浓度 / mol·L-1 | 浸出率/% | 浸出温度/℃ | 浸出率/% | |
Cu Ag Au Se Te | Cu Ag Au Se Te | |||
4 | 95.1 4.67 <0.2 0.83 8.93 | 30 | 87.1 4.58 <0.2 0.08 6.83 | |
3 | 94.5 4.65 <0.2 0.28 6.90 | 40 | 94.5 4.65 <0.2 0.28 6.90 | |
2 | 78.1 2.65 <0.2 0.05 2.85 | 50 | 96.1 5.90 <0.2 0.64 8.73 |
(1)步骤I的主要目的为浸出铜,发生的主要反应的化学方程式为__________;分析表2数据,可知步骤I最适合的条件为______________。
(2)步骤II中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为________。
(3)步骤III的操作方法为___________。
(4)步骤IV中,反应温度为75℃。加入H2O2溶液作用为______________;此过程中H2O2溶液的添加量要远远高于理论值,原因为_____________。
(5)步骤VI中所发生反应的化学方程式为_______。
(6)步骤VII中,碱性环境下电解Na2TeO3溶液可得Te实现,阴极的电极反应式为_____。
【答案】2Cu+O2+2H2SO4=2CuSO4+2H2O 硫酸浓度3 mol·L-1、浸出温度40℃ 除去滤液中的Ag+ 加热浓缩(蒸发)、冷却结晶、过滤 氧化滤渣中的硒和碲,使其进入溶液中 增加硒和碲的浸出率、H2O2会有部分分解 Na2SeO3+2Na2SO3+2HCl=Se+2Na2SO4+2NaCl+H2O TeO32—+4e-+3H2O=Te+6OH-
【解析】
(1)根据阳极泥的成分和流程图,及题目要求,主要反应是铜与硫酸及空气中氧气的反应,配平方程式即可;根据题目中所给表格②中数据分析,综合考虑浸出率和经济性等原则得出结论;
(2)步骤Ⅱ中,加入NaCl的目的显然是使Ag+转化为氯化银沉淀而除去;
(3)使结晶水合物从溶液中结晶析出的步骤是:蒸发浓缩、冷却结晶、过滤等;
(4)步骤Ⅳ中,反应温度为75℃.加入H2O2溶液的作用为氧化滤渣中的硒和碲,使其进入溶液中;此过程中H2O2溶液的添加量要远远高于理论值,原因是:从速率及平衡角度考虑,可增加硒和碲的浸出率,H2O2会有部分分解,有损失;
(5)根据流程图中的反应物和生成物,配平方程式即可;
(6)根据反应物Na2TeO3和生成物Te,结合碱性条件,阴极应发生还原反应,根据守恒即可写出其电极反应式。
(1)根据阳极泥的成分和流程图及题目要求,主要反应是铜与硫酸及空气中氧气的反应,反应的方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O;根据题目中所给表格②中数据分析,可知当硫酸浓度为2 molL-1、浸出温度30℃时浸出率太低,硫酸浓度为3 molL-1、浸出温度40℃时浸出率已较高,再增大浓度和升温对浸出率影响不大,但会浪费试剂和能源;故可知步骤I最适合的条件为 :硫酸浓度3 molL-1、浸出温度40℃;
(2)步骤Ⅱ中,加入NaCl的目的显然是使Ag+转化为氯化银沉淀而除去;
(3)使结晶水合物从溶液中结晶析出的步骤是:蒸发浓缩、冷却结晶、过滤等;
(4)硒和碲不溶于水,步骤Ⅳ中,反应温度为75℃.加入H2O2溶液的作用为氧化滤渣中的硒和碲,使其进入溶液中;此过程中H2O2溶液的添加量要远远高于理论值,原因是:从速率及平衡角度考虑,可增加硒和碲的浸出率;H2O2会有部分分解;
(5)根据流程图中的反应物和生成物,根据得失电子守恒、原子守恒,反应的方程式为Na2SeO3+2Na2SO3+2HCl=Se+2Na2SO4+2NaCl+H2O;
(6)根据反应物Na2TeO3和生成物Te,结合碱性条件,阴极应发生还原反应,根据守恒即可写出其电极反应式TeO32-+4e-+3H2O=Te+6OH-。


科目:高中化学 来源: 题型:
【题目】草酸锌晶体是一种微溶于水的白色粉末,可用于制纳米氧化锌、照相乳剂等。以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料生产草酸锌晶体(ZnC2O4·2H2O)的流程如下:
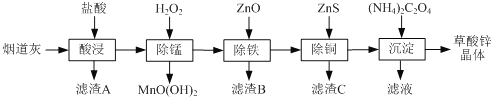
下列说法不正确的是( )
A.滤渣A、滤渣B的主要成分分别为SiO2和Fe(OH)3
B.“除锰”时发生的离子反应为Mn2++H2O2+H2O=MnO(OH)2↓+2H+
C.流程中“除铁”与“除铜”顺序可以颠倒
D.“合成”时过滤所得滤液主要溶质为NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在严格无氧的条件下,碱与亚铁盐溶液反应生成白色胶状的 Fe(OH)2,在有氧气的情况下迅速 变为灰绿色,逐渐形成红褐色的氢氧化铁,故在制备过程中需严格无氧。现提供制备方法如下:
方法一:用 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)配制 FeSO4 溶液时需加入铁粉的原因是_____;除去蒸馏水中溶解的 O2常采用_____的方法。
(2)生成白色 Fe(OH)2 沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入 FeSO4 溶液液面下,再挤出 NaOH 溶液。这样操作的理由是_____。
方法二:
在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备。

(1)在试管Ⅰ里加入的试剂是_____;
(2)在试管Ⅱ里加入的试剂是_____;
(3)为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤 是_____。
(4)这样生成的 Fe(OH)2 沉淀能较长时间保持白色,其理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中都分别加入2molX和2molY,开始时容器的体积均为VL,发生如下反应并达到平衡状态:2X(?)+ Y(?)![]() a Z(g)。
a Z(g)。
此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断不正确的是
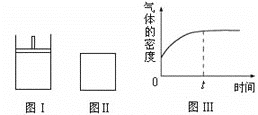
A. 物质Z的化学计量数a =1
B. 若X、Y均为气态,则在平衡时X的转化率:Ⅰ>Ⅱ
C. 若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
D. 若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在测定空气里氧气含量的实验中,小明采用了如图所用的装置:
装置一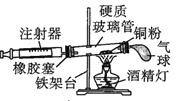 装置二
装置二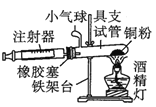
在由注射器和硬质玻璃管组成的密闭系统中留有40mL空气,给装有铜粉的玻璃管加热,观察密闭系统内空气体积变化。
(1)在实验加热过程中,缓慢推动注射器活塞的目的是__________。
(2)装置一比装置二更______(填“合理”或“不合理”),理由是_________。
(3)小明测得的实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
15mL | 10mL |
由此数据可推算出他测定的氧气的体积分数________21%(填“>”“<”或“=”),造成该实验出现误差的原因可能是____________(填序号)。
①推动注射器活塞速度太快 ②未冷却至室温就读数 ③加入铜粉量太少
Ⅱ.H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。
图甲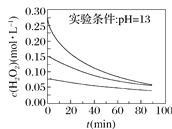 图乙
图乙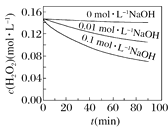
(4)根据上图,将不同条件对速率的影响情况补充完整:图甲表明,____________,H2O2分解速率越快;图乙表明,_________,H2O2分解速率越快。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A、C、E是常见的金属单质,E为紫红色,反应①可用于焊接铁轨,B是赤铁矿的主要成分,F的溶液中加入KSCN溶液变红。(部分反应物和生成物省略)
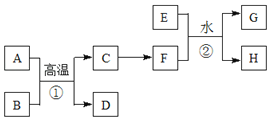
请回答下列问题:
(1)B的化学式是____________D的化学式是_____________
(2)可选用__________(填“字母”)实现反应C→F的转化。
a.稀盐酸 b.氯气/点燃 c.CuSO4溶液
(3)反应①的化学方程式为___________________________。
(4)反应②的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应是化学实验现象的本质,根据描述回答下列问题:
(1)在BaCl2溶液中通入SO2气体,未见沉淀生成,若先通入或加入下列的另一种物质,再通入SO2能看到沉淀的有___(填序号)。
①NO2 ②NH3 ③HCl ④FeCl3溶液 ⑤CO2
(2)A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
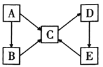
若A为金属单质,B、C均属于盐类,B溶液呈黄色,与硫氰化钾溶液混合后显红色,D是一种白色沉淀,E是一种不溶性碱。B溶液呈酸性的原因是___(用离子方程式表示);选用氢碘酸可与E反应实现E→C的转化,该反应的离子方程式为___。
(3)①通常条件下,未经碾磨的镁粉和未经擦拭的镁条跟冷水不反应,因为表面有一层保护膜。去除这层氧化膜后,镁与冷水就会发生明显的反应,看到有大量细腻的气泡产生。在室温条件下,反应生成的难溶于水的氢氧化镁,沉积在表面形成致密薄膜,几分钟后,反应很快停止。给反应混合液加热,镁跟水的作用又会重新进行,你觉得可能的原因是:___,此时滴加酚酞试液,___(填“会”或“不会”)出现溶液变红的现象。
②取一段擦去表层氧化膜的镁条,卷成螺旋状,插入盛满食盐水的试管中,将试管倒扣在盛有食盐水的烧杯中,可以迅速观察到镁持续不断地跟水反应,你觉得可能的原因是___。
③去除了氧化膜的金属Mg可以与NaHCO3溶液作用析出氢气,溶液中有白色难溶物生成。这是由于镁直接与水反应,转化为H2和Mg(OH)2。溶解在水中的少量Mg(OH)2电离生成的OH-与溶液中的HCO3-反应生成CO32-,促使反应生成的Mg(OH)2更多溶解。溶液中Mg2+、OH-、CO32-,结合析出白色难溶物Mg2(OH)2CO3。请根据以上信息写出Mg与NaHCO3溶液的总反应式:___(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
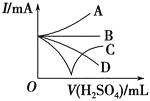
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式:________________________________________。
(2)下列三种情况下,离子方程式与 (1)相同的是_______(填序号)。
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图中的_______(填序号)曲线表示。
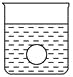
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯中缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com