
化学与生活密切相关。下列说法不正确的是( )
A.乙烯可作水果的催熟剂
B.硅胶可作袋装食品的干燥剂
C.福尔马林可作食品的保鲜剂
D.氢氧化铝可作胃酸的中和剂
科目:高中化学 来源: 题型:
下列解释事实的方程式不正确的是( )
A.测0.1 mol/L氨水的pH为11:
NH3·H2O NH
NH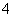 +OH-
+OH-
B.将Na块放入水中,产生气体:
2Na+2H2O===2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:
CuCl2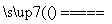 Cu2++2Cl-
Cu2++2Cl-
D.Al片溶于NaOH溶液中,产生气体:
2Al+2OH-+2H2O===2AlO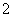 +3H2↑
+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
H2SO4溶解A12O3的离子方程式是
KMnO4 - 氧化Fe2+的离子方程式补充完整:
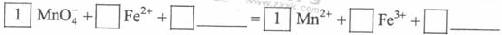
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的: 。
(4)己知:一定条件下,MnO4 - 可与Mn2+反应生成MnO2。
① 向 Ⅲ 的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 。
② Ⅳ 中加入MnSO4的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH = 2Fe(OH)3 + 2KI; 3I2 + 6KOH = 5KI + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 = 2KSCN + CO2 ↑ + H2O; KCN + CO2 + H2O = HCN + KHCO3
热分解反应:
4NaClO  3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4  NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是:
A.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2
B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3
C.热稳定性:NaCl > NaClO4 > NaClO
D.酸性(水溶液):HSCN > H2CO3 > HCN
查看答案和解析>>
科目:高中化学 来源: 题型:
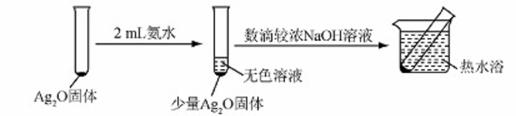
有文献记载:在强碱条件下,加热银氨溶液可能析出银镜。某同学进行如下验证和对比实验。
| 装置 | 实验序号 | 试管中的药品 | 现象 |
|
| 实验Ⅰ | 2mL银氨溶液和数 滴较浓NaOH溶液 | 有气泡产生: 一段时间后,溶液 逐渐变黑:试管壁 附着银镜 |
| 实验Ⅱ | 2mL银氮溶液和 数滴浓氨水 | 有气泡产生: 一段时间后,溶液 无明显变化 |
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料:
a.
b.AgOH不稳定,极易分解为黑色Ag2O
(I)配制银氨溶液所需的药品是 。
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.
①用湿润的红色石蕊试纸检验NH3产生的现象是 。
②产生Ag2O的原因是 。
(3)该同学对产生银镜的原因提出瑕设:可能是NaOH还原Ag2O。实验及现象:向AgNO3
 溶液中加入 ,出现黑色沉淀;水浴加热,未出现银镜。
溶液中加入 ,出现黑色沉淀;水浴加热,未出现银镜。
(4)重新假设:在NaOH存在下.可能是NH3,
还原Ag2O。用右图所示装置进行实验.现象:
出现银镜。在虚线框内画出用生石灰和浓
氨水制取NH3的装置简图(夹持仪器 略)。
略)。
(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成.由此又提出假设:在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3,还原Ag2O的反应.进行如下实验:
有部分Ag2O溶解在氨水中,该反应的化学方程式是 。
验结果证实假设成立,依据的现象是 。
用HNO3,消洗试管壁上的Ag,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质分类的说法正确的是( )
A.金刚石、白磷都属于单质
B.漂白粉、石英都属于纯净物
C.氯化铵、次氯酸都属于强电解质
D.葡萄糖、蛋白质都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同
B.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸
C.用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率
D.用AgNO3溶液可以鉴别KCl和KI
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
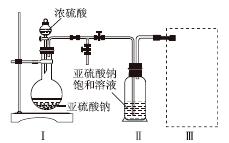
(1)装置Ⅰ中产生气体的化学方程式为______________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
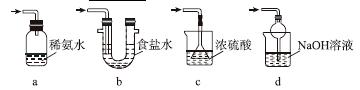
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液
c.加入盐酸 d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检测Na2S2O5晶体在空气中已被氧化的实验方案是
________________________________________________________________________
________________________________________________________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
我国缺碘病区甚广,防治缺碘病的主要措施是食盐中加碘.1996年我国政府以国家标准的方式规定食盐的碘添加剂是KIO3.
(1)可用盐酸酸化的KI淀粉混合物检验食盐是否为加碘盐,反应的化学方程式为 .
(2)可用电化学方法制备KIO3.原理是:以石墨为阳极,不锈钢为阴极,以KI溶液(加入少量K2Cr2O7)为电解质溶液,在一定电流强度和温度下进行电解,其电解总反应方程式为KI+3H2O KIO3+3H2↑.试写出两极反应式:阳极 ;阴极 .
KIO3+3H2↑.试写出两极反应式:阳极 ;阴极 .
(3)如果在容积为10L的离子交换膜电解槽中,1min时阴极可产生11.2L(标准状况)Cl2,这时溶液的pH是(设体积维持不变) .
(4)Cl2常用于自来水的消毒杀菌,现有一种新型消毒剂ClO2,若它们在杀菌过程中的还原产物均为Cl﹣,消毒等量的自来水,所需Cl2和ClO2的物质的量之比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com