
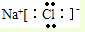 .
.分析 (1)分析反应中各元素化合价变化,依据氧化还原反应得失电子守恒、原子个数守恒配平方程式;
(2)反应物质所含元素化合价降低的为氧化剂,所含元素化合价升高的元素被氧化,氯化钠为离子化合物,钠离子和氯离子通过离子键结合,据此书写电子式;
(3)依据方程式元素化合价变化判断电子转移数目;
(4)依据m=CVM计算需要氢氧化钠质量,依据配制一定物质的量浓度溶液一般步骤选择需要仪器.
解答 解:(1)反应中Fe(OH)3→Na2FeO4,Fe元素化合价由+3价升高为+6价,总共升高3价,NaClO→NaCl,Cl元素的化合价由+1价降低为-1价,总降低2价,化合价升降最小公倍数为6,故系数为,故Fe(OH)3系数为2,故NaClO系数为3,由Fe元素守恒故Na2FeO4系数为3,由Cl元素守恒NaCl系数为3,由Na元素守恒NaOH系数为4,由H元素守恒H2O系数为5,配平后方程式为:2Fe(OH)3+4 NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O,
故答案为:2;4;3;2;3;5;
(2)该反应中氧化剂是次氯酸钠,铁元素化合价升高,被氧化,次氯酸钠被还原对应还原产物为氯化钠,氯化钠为离子化合物,钠离子和氯离子通过离子键结合,电子式: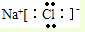 ;
;
故答案为:次氯酸钠;铁;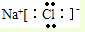 ;
;
(3)依据方程式元素化合价变化可知,反应有2molNa2FeO4生成,转移6mol的电子,则生成1molNa2FeO4,转移3mol电子;
故答案为:3;
(4)如果配制250mL0.1mol/LNaOH溶液,需要称取氢氧化钠质量为:0.25L×0.1mol/L×40g/mol=1.0g,用到的仪器:托盘天平、钥匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,所以需要定量仪器:托盘天平、250mL容量瓶.
故答案为:1.0;托盘天平;250mL容量瓶.
点评 本题考查氧化还原反应基本概念及配平,一定物质的量浓度溶液的配制,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,注意配制一定物质的量浓度溶液的原理及操作步骤,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 已知该分子中含有四面体结构的碳原子数为a,可在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别为( )
已知该分子中含有四面体结构的碳原子数为a,可在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别为( )| A. | 2、3、5 | B. | 3、3、6 | C. | 2、5、4 | D. | 4、6、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、反应类型取代反应
、反应类型取代反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 电离常数(25℃) |
| 碳酸 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| 次溴酸 | Ka=2.4×10-9 |
| A. | HBrO+Na2CO3═NaBrO+NaHCO3 | B. | 2HBrO+Na2CO3═2NaBrO+H2O+CO2↑ | ||
| C. | HBrO+NaHCO3═NaBrO+H2O+CO2↑ | D. | NaBrO+NaHCO3═Na2CO3+HBrO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的化合物可能含有非极性键 | |
| B. | X的单质与Z的单质在暗处能剧烈反应 | |
| C. | 含W的盐溶于水形成的溶液常用于自来水的杀菌消毒 | |
| D. | 离子半径:r(Z-)>r(W3+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠离子的电子式:Na+ | B. | 碳-12原子:${\;}_{12}^{6}$C | ||
| C. | 氯化钙电子式: | D. | OH-的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe | B. | Zn | C. | Mg | D. | Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2与水反应:3NO2+H2O═2NO3-+NO+2H+ | |
| B. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+═SO2↑+H2O | |
| C. | 氨水吸收NO、NO2:NO+NO2+2OH-═2NO2-+H2O | |
| D. | NH4HCO3溶于过量浓NaOH溶液中:NH4++OH-═NH3↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com