

 ,F:CH3CHO.
,F:CH3CHO. ,
, .
.分析 有机物B的分子式为C11H12O4,不饱和度为$\frac{2×11+2-12}{2}$=6,考虑含有苯环,B的核磁共振氢谱中有5组峰,峰面积之比为2:2:2:3:3,B在氢氧化钠水溶液、加热条件下生成C与D,D酸化能够得到A,D含有连续氧化生成J,D含有醇羟基,B含有酯基,故B中含有1个苯环、1个酯基,通过G发生加聚反应的产物以及G水解生成F,F经氧化反应后,进一步反应生成C,可知C为CH3COOH,F为CH3CHO,F氧化生成的E为CH3COONa,E酸化生成C,有机物B的分子式为C11H12O4,不饱和度为$\frac{2×11+2-12}{2}$=6,考虑含有苯环,B的核磁共振氢谱中有5组峰,峰面积之比为2:2:2:3:3,B在氢氧化钠水溶液、加热条件下生成C与D,D酸化能够得到A,D能够连续氧化生成J,J酸化生成K,结合K物质与氯化铁溶液发生显色反应,且环上的一元取代物只有两种结构,可知B为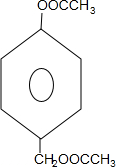 ,则A为
,则A为 ,D为
,D为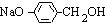 ,D氧化生成的I为
,D氧化生成的I为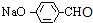 ,I进一步氧化生成的J为
,I进一步氧化生成的J为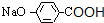 ,J酸化生成的K为
,J酸化生成的K为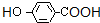 ,K发生缩聚反应生成的M为
,K发生缩聚反应生成的M为 ,据此解答.
,据此解答.
解答 解:有机物B的分子式为C11H12O4,不饱和度为$\frac{2×11+2-12}{2}$=6,考虑含有苯环,B的核磁共振氢谱中有5组峰,峰面积之比为2:2:2:3:3,B在氢氧化钠水溶液、加热条件下生成C与D,D酸化能够得到A,D含有连续氧化生成J,D含有醇羟基,B含有酯基,故B中含有1个苯环、1个酯基,通过G发生加聚反应的产物以及G水解生成F,F经氧化反应后,进一步反应生成C,可知C为CH3COOH,F为CH2=CHOH,F氧化生成的E为CH2=COOH,E催化加氢生成C,有机物B的分子式为C11H12O4,不饱和度为$\frac{2×11+2-12}{2}$=6,考虑含有苯环,B的核磁共振氢谱中有5组峰,峰面积之比为2:2:2:3:3,B在氢氧化钠水溶液、加热条件下生成C与D,D酸化能够得到A,D能够连续氧化生成J,J酸化生成K,结合K物质与氯化铁溶液发生显色反应,且环上的一元取代物只有两种结构,可知B为 ,则A为
,则A为 ,D为
,D为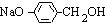 ,D氧化生成的I为
,D氧化生成的I为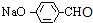 ,I进一步氧化生成的J为
,I进一步氧化生成的J为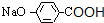 ,J酸化生成的K为
,J酸化生成的K为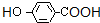 ,K发生缩聚反应生成的M为
,K发生缩聚反应生成的M为 ,
,
(1)B为 ,则B中含氧官能团名称是酯基,故答案为:酯基;
,则B中含氧官能团名称是酯基,故答案为:酯基;
(2)据分析可知,上述反应中属于水解反应的有①⑥,故答案为:①⑥;
(3)A、F的结构简式分别为: ,CH3CHO,
,CH3CHO,
故答案为: ;CH3CHO;
;CH3CHO;
(4)反应①的方程式为: ,
,
K在一定条件下得到M的方程式为:
故答案为: ;
; ;
;
(5)A为 ,其同分异构体有一下特点,
,其同分异构体有一下特点,
①能与FeCl3溶液发生显色反应,说明含有酚羟基,②1mol A与足量的钠反应产生1mol H2,说明1分子A中有2个羟基,可以是1个醇羟基和1个酚羟基,有临间对三种,两个酚羟基和1个甲基,有6种结构,共9种,故答案为:9.
点评 考查有机物的推断,是对有机物知识的综合运用,题目给出某反应信息要求学生加以应用,能较好的考查考生的阅读、自学能力和思维能力,是热点题型,判断B的结构简式是推断的关键,再利用正推法与逆推法结合推断其它物质,注意充分利用反应条件.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中加入过量浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 将含有0.1 mol Ba(OH)2的溶液与含有0.2 mol NaHSO4的溶液混合:H++SO42-+OH-+Ba2+═BaSO4↓+H2O | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | 用Cu除去CuCl2溶液中的少量FeCl3:Cu+Fe3+═Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1 Na2CO3溶液:c(Na+)=2[c(HCO3-)+c(CO32?)+c(H2CO3)] | |
| B. | 0.1 mol•L-1 NH4Cl溶液:c(NH4+)=c( Cl-) | |
| C. | 0.1 mol•L-1Na2SO3溶液 c(H+)+c( Na+)=2c( SO32-)+c( OH-) | |
| D. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol铁粉与足量水蒸气反应生成的H2分子数为0.3NA | |
| B. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 常温常压下,17g甲基(-14CH3)所含的电子数为9NA | |
| D. | 在1 L 0.1 mol/L的碳酸钠溶液中,氧原子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图所示的装置和其他必要的用品,利用反应:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O证明氨气具有还原性,请回答下列有关问题.
利用如图所示的装置和其他必要的用品,利用反应:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O证明氨气具有还原性,请回答下列有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com