
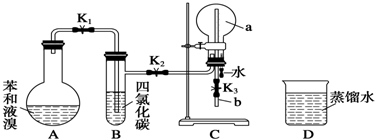
 ,能证明凯库勒观点错误的实验现象是C中产生“喷泉”现象.
,能证明凯库勒观点错误的实验现象是C中产生“喷泉”现象.分析 (1)苯与溴在溴化铁做催化剂的条件下发生取代反应,生成溴苯和溴化氢;
(2)由于反应放热,苯和液溴均易挥发,溴的存在干扰检验H+和Br-;
(3)除去混合酸后,粗溴苯中主要含有苯、少量的酸、水等杂质,需进一步精制,操作为水洗、用10%的NaOH溶液洗、水洗、用干燥剂干燥、蒸馏.
(4)根据相对密度进行计算;
解答 解:(1)苯与溴在溴化铁做催化剂的条件下生成溴苯和溴化氢,苯分子里的氢原子被溴原子所代替,
方程式为: ,该反应为取代反应,不是加成反应,所以苯分子中不存在碳碳单双键交替,所以凯库勒观点错误,生成的溴化氢极易溶于水,所以C中产生“喷泉”现象,
,该反应为取代反应,不是加成反应,所以苯分子中不存在碳碳单双键交替,所以凯库勒观点错误,生成的溴化氢极易溶于水,所以C中产生“喷泉”现象,
故答案为: ,C中产生“喷泉”现象;
,C中产生“喷泉”现象;
(2)由于反应放热,苯和液溴均易挥发,苯和溴极易溶于四氯化碳,用四氯化碳除去溴化氢气体中的溴蒸气和苯,以防干扰检验H+和Br-,
故答案为:除去未反应的苯蒸气和溴蒸气;
(3)产品粗溴苯的精制,应先水洗,除去溶有的JBr酸,再用10%NaOH溶液洗涤,将Br2转化为易溶于水的NaBr和NaBrO,然后水洗、干燥,最后蒸馏,故正确的顺序为②④⑤③①,故答案为:②④⑤③①;
(4)烧瓶中混合气体对H2的相对密度为24.9,故烧瓶中混合气体的平均分子量为24.9×2=49.8,
设HBr的体积为x,空气的体积为y,则:
$\frac{81x}{500}+\frac{29y}{500}=49.8$①
x+y=500②
解①②得:x=200mL,y=300mL,
故进入烧瓶中的水的体积为x=200mL,
故答案为:200mL.
点评 本题以实验为载体考查了有机物苯的性质,理清实验原理是解答的关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用四氯化碳萃取碘单质,静置,上层显示紫红色 | |
| B. | 坩埚需要垫石棉网加热 | |
| C. | 蒸馏时温度计水银球可以高于蒸馏烧瓶支管口 | |
| D. | 蒸发时用玻璃棒和向容量瓶移液时用玻璃棒用途不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
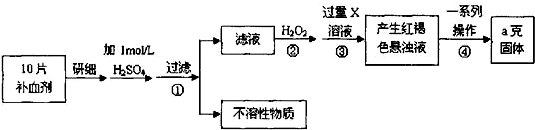
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.04 mol/(L•s) | B. | 0.12 mol/(L•s) | C. | 0.4 mol/(L•s) | D. | 1.2 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PVC保鲜膜属于链状聚合物,在加热时易熔化,能溶于氯仿 | |
| B. | 汽车尾气排放的NO2等气体是造成光化学污染的主要原因 | |
| C. | 点燃爆竹后,硫燃烧生成SO3 | |
| D. | 误食含有大量Cu2+的食物可以服用鲜牛奶解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
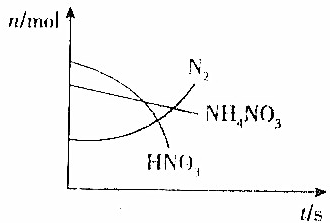 某容器中发生一个化学反应,反应过程中存在Zn、H2O、HNO3、N2、NH4NO3和Zn(NO3)2六种物质,在反应过程中测得HNO3、NH4NO3和N2的物质的量随时间变化的曲线如图所示,下列判断正确的是( )
某容器中发生一个化学反应,反应过程中存在Zn、H2O、HNO3、N2、NH4NO3和Zn(NO3)2六种物质,在反应过程中测得HNO3、NH4NO3和N2的物质的量随时间变化的曲线如图所示,下列判断正确的是( )| A. | N2是还原产物,Zn(NO3)2是氧化产物 | |
| B. | NH4NO3是氧化剂,Zn是还原剂 | |
| C. | 反应生成1molN2时共有5mol电子转移 | |
| D. | HNO3在反应中没有表现出酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com