
| 选项 | 实验操作和现象 | 结论 |
| A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
| B |  | 反应结束后,锥形瓶中溶液的溶质是Cu(NO3)2、CuSO4,集气瓶中收集到的气体是NO |
| C | 向1mL浓度均为0.05mol•L-l NaCl、NaI的混合溶液中滴加2滴0.01mol•L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp (AgCl)>Ksp(AgI) |
| D | 室温下,用pH试纸测得0.1mol•L-1 NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.白色沉淀为AgCl或硫酸钡;
B.Cu过量,硫酸根离子不反应,Cu、硝酸根离子、氢离子以3:2:8反应;
C.混合溶液中滴加2滴0.01mol•L-1 AgNO3溶液,Ksp小的先沉淀;
D.pH约为5,溶液显酸性.
解答 解:A.白色沉淀为AgCl或硫酸钡,则溶液X中可能含有SO42-,故A正确;
B.Cu过量,硫酸根离子不反应,Cu、硝酸根离子、氢离子以3:2:8发生氧化还原反应,发生3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,则反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO,故B错误;
C.混合溶液中滴加2滴0.01mol•L-1 AgNO3溶液,Ksp小的先沉淀,则Ksp(AgCl)>Ksp(AgI),故C正确;
D.pH约为5,溶液显酸性,可知HSO3-的电离程度大于其水解程度,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握离子检验、沉淀生成、氧化还原反应、电离与水解、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| 化学性质 | 应用 | |
| A | O价铁具有还原性 | 铁粉可用于食品中的脱氧剂 |
| B | 明矾与NaOH生成Al(OH)3 | 明矾可作净水剂 |
| C | Fe的金属性比Cu活泼 | FeCl3浓溶液腐蚀Cu刻制印刷电路板 |
| D | NaHCO3水解显碱性 | 发酵粉中含有NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 同分异构体 | B. | 同素异形体 | C. | 同位素 | D. | 同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
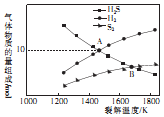 硫化氢是天然气及石油中的含硫杂质,近年来发现H2S可用于高效制取氢气.
硫化氢是天然气及石油中的含硫杂质,近年来发现H2S可用于高效制取氢气.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 有浸有高锰酸钾溶液的硅土作水果保鲜剂 | 高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| B | 用氢氟酸蚀刻玻璃 | SiO2虽然是酸性氧化物,但能溶于氢氟酸 |
| C | 常温下,可用铁、铝制容器盛装浓硫酸或浓硝酸 | 铁表面被氧化为致密的氧化物薄膜,这层薄膜阻止了酸与内层金属的进一步反应 |
| D | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2O2与足量KMnO4反应,转移电子数为2NA | |
| B. | 4.4g CO2和N2O的混合气体含有的原子数为0.3NA | |
| C. | 22.4L NH3含有的电子数为10NA | |
| D. | 25℃、101kPa,2.24LCH4含有的共价键数小于0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 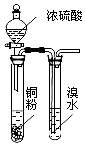 用图所示装置验证浓硫酸具有强氧化性 | |
| B. | 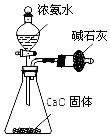 用图所示装罝制取干燥的 NH3 | |
| C. | 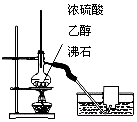 用图所示装置制取并收集乙烯 | |
| D. | 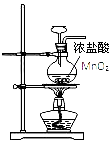 用图所示装置制取 Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | B. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | ||
| C. | 3Mg+Fe2O3═3MgO+2Fe | D. | Al+Fe2O3═Al2O3+Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com