
【题目】![]() 是一种有机烯醚 ,可以烃用 A 通过下列路线制得:
是一种有机烯醚 ,可以烃用 A 通过下列路线制得:
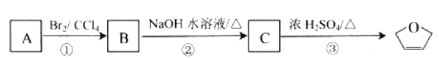
则下列说法正确的是
A.![]() 分子式为C4H4O
分子式为C4H4O
B.A的结构简式是CH2=CHCH2CH3
C.![]() 分子中所有原子可能共面
分子中所有原子可能共面
D.①②③的反应类型分别为加成、水解、取代
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下列有关溶液中粒子浓度的关系式中,正确的是( )
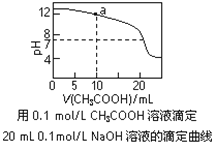
A.pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
D.图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为常见的金属单质,根据下图所示的关系:

下列叙述中不正确的是
A. A为Fe,B为Fe3O4
B. C→D溶液的颜色变化:由浅绿色到黄色
C. ④的离子方程式:Fe+Fe3+===2Fe2+
D. ⑧的化学方程式:4Fe(OH)2+O2+2H2O===4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推的思维方法在化学学习与研究中可能会产生错误的结论,因此类推出的结论需经过实践的检验才能确定其正确与否。下列几种类推结论正确的是
A.金刚石中C—C键的键长为154.45 pm, C60中C—C键的键长为 140~ 145 pm,所以C60的熔点高于金刚石
B.CO2晶体是分子晶体,SiO2晶体也是分子晶体
C.从CH4 、![]() 、
、![]() 为正面体结构,可推测CC14、
为正面体结构,可推测CC14、![]() 、
、![]() 也为正四面体结构
也为正四面体结构
D.H2O常温下为液态,H2S常温下也为液态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g) △H,在密闭容器中进行,下图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线。由曲线分析,下列判断正确的是
p C(g) △H,在密闭容器中进行,下图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线。由曲线分析,下列判断正确的是

A. T1<T2,P1>P2,m+n>p,△H<0
B. T1>T2,P1<P2,m+n>p,△H>0
C. T1<T2,P1>P2,m+n<p,△H<0
D. T1>T2,P1<P2,m+n<p,△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、E、F五种常见物质含有同一元素M,在一定条件下它们有如下转化关系,Z是NO,下列推断不合理的是:
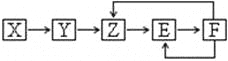
A. X可能是一种氢化物
B. 若Y为单质,Y生成Z属于化合反应
C. E可能是一种有色气体
D. F中M元素的化合价可能为+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铜易溶于水,在130 ℃时会发生分解反应,是一种燃烧催化剂。以食盐等为原料制备高氯酸铜[Cu(ClO4)2·6H2O]的一种工艺流程如图1所示:
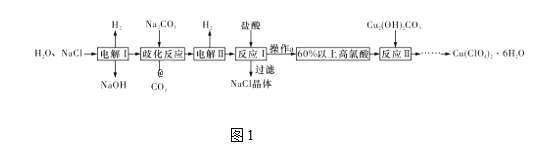
(1)发生“电解Ⅰ”时,所用的交换膜是____(填“阳”或“阴”)离子交换膜。
(2)歧化反应是同一种物质中同种元素自身的氧化还原反应。已知上述工艺流程中“歧化反应”的产物之一为氯酸钠,则“歧化反应”的化学方程式为________。
(3)“电解Ⅱ”主要的阳极产物是_________(填离子符号)。
(4)操作a的名称是____。
(5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a t,最终制得Cu(ClO4)2·6H2O为b t,则产率为____ (用含a,b的代数式表示)。
(6)某温度下,高氯酸铜[Cu(ClO4)2]按A、B两种方式同时分解,分解过程中铜的化合价不发生改变。方式A为Cu(ClO4)2![]() CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50% 的方式完全分解,且A、B两种方式转移的电子数之比为8∶7,则方式B为____ (用化学方程式表示)。
CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50% 的方式完全分解,且A、B两种方式转移的电子数之比为8∶7,则方式B为____ (用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2和SCl2均为重要的化工原料,都满足8电子稳定结构。
已知:①S2(1)+Cl2(g)![]() S2Cl2(g) △H1=xkJ/mol
S2Cl2(g) △H1=xkJ/mol
②S2Cl2(g)+Cl2(g)![]() 2SCl2(g) △H2=ykJ/mol
2SCl2(g) △H2=ykJ/mol
③相关化学键的键能如下表所示:
化学键 | S-S | S-Cl | Cl-Cl |
键能/kJ/mol | a | b | c |
下列说法错误的是
A. SCl2的结构式为C1-S-Cl B. S2Cl2的电子式为: ![]()
C. y=2b-a-c D. 在S2(1)+2Cl2(g)![]() 2SCl2(g)的反应中,△H=(x+y)kJ/mol
2SCl2(g)的反应中,△H=(x+y)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是一种银白色的碱土金属,镁元素在地壳中的含量约为2.00%,位居第八位,镁及其化合物在研究和生产中具有广泛用途。请回答下列问题:
(1)在室温下,纯净的氮化镁(Mg3N2)为黄绿色的粉末,能与水反应,常用作触媒,实验室用如图1所示装置和药品制备少量氮化镁。
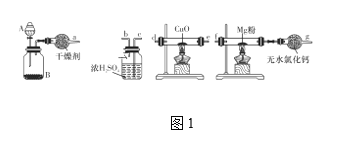
①A中盛装的是____,B中可盛装碱石灰,二者混合可制取氨气。
②按照气流的方向从左至右连接装置:a接____、____接____、_b__接____。
③气体通过CuO这一装置的目的是什么?用化学方程式回答:______。
④无水氯化钙装置可防止外界空气中的水进入,以防_____________(化学方程式表示)的发生。
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。
Ⅰ.合成碳酸镁晶体的步骤如下:
步骤1:配制0.5 mol·L-1MgSO4溶液和0.5 mol·L-1NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到产品碳酸镁晶体(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、____。
②步骤3中加氨水后发生反应的离子方程式为________________
Ⅱ.测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶体,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶体反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。
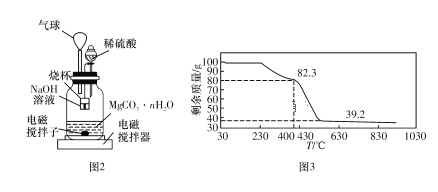
③上述反应后期要升温到30 ℃,主要目的是_____________________
④若实验测得1.000 g碳酸镁晶体产生CO2的平均物质的量为a mol,则n为__________(用含a的表达式表示)。
⑤若称取100 g上述晶体进行热重分析,得到的热重曲线如图3所示,则合成的晶体中n=____(取整数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com