
【题目】秋冬季节是流感发作的高峰期,“84消毒液”能有效杀灭流感病毒。三台中学某同学购买的“84消毒液”瓶体部分标签如图所示,通常稀释100倍(体积比)后使用。请回答下列问题:
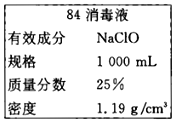
(1)该“84消毒液”的物质的量浓度约为______mol/L。
(2)该同学参阅“84消毒液”的配方,欲用NaClO固体配制240 mL浓度为0.4mol/L的消毒液:
①需要用托盘天平称量NaClO固体的质量为____________g。
②实验中所用的玻璃仪器除烧杯、玻璃棒、量筒外,还有_____________________。
(3)实验过程中下列操作或说法不正确的是_______________。
A、容量瓶用蒸馏水洗净之后,应烘干后才能用于溶液的配制
B、配制过程中,未用蒸馏水洗涤烧杯和玻璃棒会导致所得溶液浓度偏低
C、定容时,俯视刻度线会导致所得溶液浓度偏低
D、摇匀后,发现液面低于刻度线,又滴加蒸馏水至与刻度线相切
【答案】4.0 7.5 250 mL容量瓶、胶头滴管 ACD
【解析】
根据配制一定物质的量浓度的溶液步骤进行分析判断所用仪器;根据c=n/V判断产生误差的大小;根据c = ![]() 计算已知溶液的浓度。
计算已知溶液的浓度。
(1)根据标签可知,“84消毒液”的物质的量浓度c = ![]() =
= ![]() =4.0mol/L;答案:4.0。
=4.0mol/L;答案:4.0。
(2)①该同学参阅“84消毒液”的配方,要用NaClO固体配制240 mL浓度为0.4mol/L的消毒液,实验室无240mL的容量瓶,需选用250mL的容量瓶进行配制,需要用托盘天平称量NaClO固体的质量为0.25L![]() 74.5g/mol=7.5g。答案:7.5g;
74.5g/mol=7.5g。答案:7.5g;
②实验中所用的玻璃仪器除烧杯、玻璃棒、量筒外,还需要250 mL容量瓶、胶头滴管。答案:250 mL容量瓶、胶头滴管;
(3)A、容量瓶用蒸馏水洗净之后,就可以配置溶液了,故A错误;
B、配制过程中,未用蒸馏水洗涤烧杯和玻璃棒会损失溶质,导致所得溶液浓度偏低,故B正确;
C、定容时,俯视刻度线会导致所加溶剂偏少,所得溶液浓度偏高,故C错误;
D、摇匀后,发现液面低于刻度线,不能再滴加蒸馏水了,故D错误;答案:ACD;


科目:高中化学 来源: 题型:
【题目】某实验小组探究H2O2分解的速率及影响因素,在相同温度下按照下表所示的方案完成实验。

(1)上述实验方案中,探究的变量因素只有催化剂的实验组合是_____和_____。
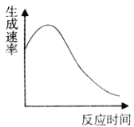
(2)实验④过程中氧气的生成速率和时间的趋势关系如图所示,判断该反应是反应(填“放热”或“吸热”)______。
(3)实验⑤:在试管中加入10mL 0.4mol/L H2O2溶液,加入固体催化剂,在一定温度下测得不同时刻生成O2的体积(以折算为标准状况)如下表所示(假设反应过程溶液的体积保持不变):
![]()
①反应6min,H2O2分解了_______%。
②0至6min,以H2O2的浓度变化表示的反应速率为υ(H2O2)=________molL-1min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa时,能量转化如图,下列说法正确的是
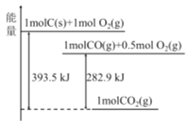
A.热化学方程式2CO(g)+O2(g)=2CO2(g)+282.9kJ
B.CO2是由极性键构成的极性分子
C.1molC(s)与1molCO2(g)生成2molCO(g)反应为放热反应
D.相同条件下,1molC(s)和0.5molO2(g)总能量高于1molCO(g)的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物与人类生产、生活密切相关。
(1)已知:S(s)+O2(g)= SO2(g) ΔH1=-a kJ·mol-1
S(g)+O2(g)= SO2(g) ΔH2=- b kJ·mol-1
则a___(填“>”或“<”)b。
(2)在一定温度和压强下,将2molSO2和1molO2置于密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g),并达到平衡。
2SO3(g),并达到平衡。
①若再加入1 molO2,该平衡向___(填“正”或“逆”)反应方向移动;
②若降低温度,达到平衡时测得SO2的含量减少,则正反应是___(填“吸热”或“放热”)反应;
③该反应的化学平衡常数表达式K=___。若只增大压强,则K__(填“增大”“减小”或“不变”)。
(3)常温下,现有0.5mol·L-1Na2SO3溶液,请判断:(Na2SO3第一步水解的离子方程式是SO32-+H2O![]() HSO3-+OH-)
HSO3-+OH-)
①该溶液的pH___(填“>”或“<”)7;
②该溶液中c(Na+)___(填“>”或“<”)2c(SO32-);
③盐类水解反应是吸热反应。加热该溶液,SO32-的浓度将__(填“增大”或“减小”)。
(4)如图是电解硫酸铜溶液的装置。
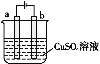
①若a、b为石墨电极,b电极的质量增加,写出该极的电极反应式:___;
②电镀是电解原理的一种重要应用。若利用该装置在铁件上镀铜,则铁件应与电源的__ (填“正极”或“负极”)连接。
(5)已知硫酸钡的沉淀溶解平衡为:BaSO4(s)![]() Ba2+(aq)+SO42-(aq) Ksp=1.0×10-10。在硫酸钡的饱和溶液中Ba2+的浓度为____mol·L-1。
Ba2+(aq)+SO42-(aq) Ksp=1.0×10-10。在硫酸钡的饱和溶液中Ba2+的浓度为____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某此气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置),用此装置和相关试剂不能制取的气体是( )
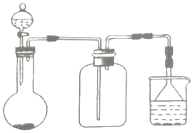
A.NH3B.SO2C.NO2D.Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积固定的密闭容器中发生反应:C(s)+H2O(g) ![]() CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
A. 容器内CO的物质的量分数保持不变B. 容器内体系的压强保持不变
C. 容器内气体的密度保持不变D. 单位时间内消耗1molH2O(g),同时生成1molCO(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
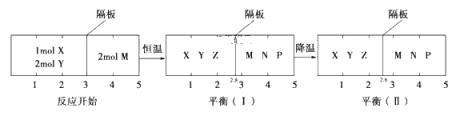
下列判断正确的是( )
A. 反应①的正反应是吸热反应
B. 达平衡(Ⅰ)时,X的转化率为5/6
C. 在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
D. 对于反应②,平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为10:11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,A、B、C三种气体在2L密闭容器中进行反应,在不同反应时间各物质的物质的量的变化情况如图所示。
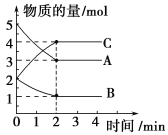
(1)该反应的化学方程式为___________________。
(2)反应开始至2 min时,用C表示的反应速率 = _____________。
(3)B的转化率= __________________。
(4)下列可判断反应已达到平衡状态的是___________。
a.A、B、C的反应速率相等 b.A、B的反应速率之比为2∶1
c.混合气体的压强不变 d.生成1 mol C的同时消耗1 mol A和0.5 mol B
e.混合气体的密度不变 f.混合气体的平均相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里,用足量的浓盐酸与一定量的MnO2反应,来制取氯气。
⑴用“双线桥法”标出电子转移情况
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
⑵若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
①理论上需要多少克MnO2参加反应?
②被氧化的HCl的物质的量为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com