
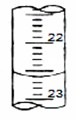
| 滴定次数 | 待测液体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4+与HCO3—均可以水解,故NH4HCO3是弱电解质 |
| B.25℃时,1L pH=3的盐酸与1L pH=11的氨水能恰好中和 |
| C.25℃时,用pH试纸测定出某醋酸溶液的pH=3.50 |
| D.25℃时,pH=14的溶液中,Na+、CO32—、K+、ClO—可以大量共存 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1×10-14 | B.1×10-13 | C.1.32×10-14 | D.1.32×10-15 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.PH=7的溶液 | B.c(H+)=10-7mol/L的溶液 |
| C.酸碱恰好完全中和的溶液 | D.c(H+)= c(OH-)=3.5×10-7mol/L的溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.此时水的离子积KW=1×10-14 |
| B.水电离出的c(H+)=1×10-10mol·L-1 |
| C.水的电离程度随温度升高而增大 |
D.c(Na+)=c( ) ) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1 mol/L | B.1×10-11 mol/L | C.1×10-7 mol/L | D.1×10-3 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HCN | B.CH3COOH | C.HF | D.HNO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

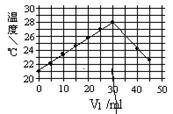
| A.当V1="=30" ml时,盐酸和NaOH溶液恰好完全反应 |
| B.NaOH溶液的浓度约为1.5 mol/L |
| C.做该实验时环境温度为22℃ |
| D.该实验表明化学能可以转化为热能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com