
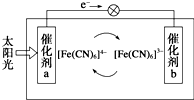
 一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )| A. | K+移向催化剂b | |
| B. | 催化剂a表面发生的化学反应:[Fe(CN)6]4--e-═[Fe(CN)6]3- | |
| C. | Fe(CN)63-在催化剂b表面被氧化 | |
| D. | 电解池溶液中的[Fe(CN)6]4-和[Fe(CN)6]3-浓度基本保持不变 |
分析 由图可知,电子从负极流向正极,则a为负极,b为正极,负极发生氧化反应,正极发生还原反应,阳离子向正极移动,以此来解答.
解答 解:由图可知,电子从负极流向正极,则a为负极,b为正极,
A.b为正极,则K+移向催化剂b,故A正确;
B.a为负极,发生氧化反应,则催化剂a表面发生反应:Fe(CN)64--e-═Fe(CN)63-,故B正确;
C.b上发生还原反应,发生Fe(CN)63-+e-═Fe(CN)64-,Fe(CN)63-在催化剂b表面被还原,故C错误;
D.由B、C中的电极反应可知,二者以1:1相互转化,电解质溶液中Fe(CN)63-和Fe(CN)64-浓度基本保持不变,故D正确;
故选C.
点评 本题考查原电池的工作原理,为高频考点,把握电子的流向判断正负极为解答的关键,明确原电池工作原理即可解答,题目难度不大.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题
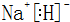 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2O2和C3H6O2一定互为同系物 | |
| B. | 碳酸钠溶液可用于鉴别乙酸和乙酸乙酯 | |
| C. | 用溴水可以除去溶解在苯中的少量苯酚 | |
| D. | 粮食酿酒过程中,淀粉在酶的催化作用下最终水解为乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用漂白液时不可与酸性洁厕剂混用 | |
| B. | 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素 | |
| C. | 葡萄糖、油脂、蛋白质等进入人体内经水解后被吸收 | |
| D. | 铝壶表面有致密氧化膜耐腐蚀,可长期存放食醋 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
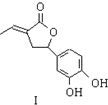 内酯类化合物在药物、涂料等应用广泛.
内酯类化合物在药物、涂料等应用广泛. +$\frac{1}{2}$O2+CO2$\stackrel{催化剂}{→}$
+$\frac{1}{2}$O2+CO2$\stackrel{催化剂}{→}$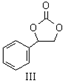
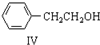 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$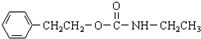 +H2O
+H2O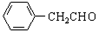 ;由IV生成II的反应条件为浓硫酸、加热.
;由IV生成II的反应条件为浓硫酸、加热.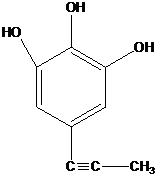 .
.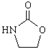 ,涉及的反应方程式为BrCH2CH2-NH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH2NH2、HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$
,涉及的反应方程式为BrCH2CH2-NH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH2NH2、HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$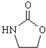 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1溴丙烷与NaOH的醇溶液共热 | B. | 乙醛与H2加成 | ||
| C. | 乙醇与浓H2SO4共热到140℃ | D. | 1-溴丙烷与NaOH的水溶液共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101 kPa时,1 mol H2完全燃烧生成气态水,放出285.8 kJ热量,H2的燃烧热为285.8 kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| C. | 在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1.若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S的漂白性 | B. | S的还原性 | C. | SO2的漂白性 | D. | SO2的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤①中当v正(CrO42-)=2v逆(Cr2O72-)时,说明反应:2CrO42-+2H+?Cr2O72-+H2O 达到平衡状态 | |
| B. | 若向K2Cr2O7溶液中加NaOH浓溶液,溶液可由橙色变黄色 | |
| C. | 步骤②中,若要还原1 mol Cr2O72-离子,需要12 mol (NH4)2Fe(SO4)2 | |
| D. | 步骤③中,当将溶液的pH 调节至5 时,可认为废水中的铬元素已基本除尽(当溶液中c(Cr3+)≤10-5 mol/L时,可视作该离子沉淀完全) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com