
����Ŀ����һ���¶��£�������������ֱ�ͨ����ʼ�����ͬ���ܱ�������͢��У�ʹ�䷢����Ӧ��t0ʱ�������дﵽ��ѧƽ�⣬X��Y��Z�����ʵ����ı仯��ͼ��ʾ���������й��ƶ���ȷ���ǣ� ��
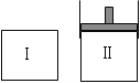
�ٸ÷�Ӧ�Ļ�ѧ����ʽΪ��3X��2Y![]() 2Z
2Z
�����������о��ﵽƽ��ʱ�������������V����V������������ﵽƽ������ʱ�����t0
�����������о��ﵽƽ��ʱ����������Z�����ʵ���������ͬ����YΪ��̬��Һ̬
������ƽ��������������¶�ʱ���������˵��Z�����ķ�ӦΪ���ȷ�Ӧ
A.�٢ڢۢ�B.�ڢ�C.�ۢ�D.�٢ڢ�
���𰸡�B
��������
����ͼ��֪��X��Y�����ʵ�������Ϊ�����Z���ʵ�����С��Ϊ��Ӧ���ƽ���X����1.8mol��Y����1.2mol��Z��Ӧ1.8mol��X��Y��Z�Ļ�ѧ������֮��=1.8��1.2��1.8=3��2��3����Ӧ�Ļ�ѧ����ʽΪ��3Z![]() 3X+2Y���ʢٴ���
3X+2Y���ʢٴ���
�ڷ�Ӧ�Ļ�ѧ����ʽΪ��3Z![]() 3X+2Y�����������о��ﵽƽ��ʱ�������������V����V������������ﵽƽ��ʱ�������ѹǿ��С�Ĺ��̣��ﵽƽ������ʱ�����t0���ʢ���ȷ��
3X+2Y�����������о��ﵽƽ��ʱ�������������V����V������������ﵽƽ��ʱ�������ѹǿ��С�Ĺ��̣��ﵽƽ������ʱ�����t0���ʢ���ȷ��
�����������о��ﵽƽ��ʱ����������Z�����ʵ���������ͬ��˵���ﵽ��ͬ��ƽ�⣬����ѹǿ�ı仯Ӱ�죬���Է�Ӧǰ���������Ӧ�Dz���ķ�Ӧ������YΪ��̬��Һ̬���ʢ���ȷ��
������ƽ����������Ǻ�ѹ�����������¶�ʱ�������������˵��ƽ��������У�Z�����ķ�Ӧ��һ��Ϊ���ȷ�Ӧ���ʢܴ���
�ڢ���ȷ����ѡB��


 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪H-H�����ܣ�����ʱ���ջ�����ʱ�ͷŵ�������Ϊ436 kJ��mol��1��H-N������Ϊ391 kJ��mol-1�������Ȼ�ѧ����ʽ��N2��g�� +3H2��g�� =2NH3��g�� ��H=��92.4 kJ��mol��1����N��N���ļ�����_________��
��2����֪�����Ȼ�ѧ����ʽ��
��Fe2O3��s����3CO��g�� = 2Fe��s����3CO2��g�� ��H����25 kJ��mol-1
��3Fe2O3��s����CO��g�� = 2Fe3O4��s����CO2��g�� ��H����47 kJ��mol-1
��Fe3O4��s����CO��g�� = 3FeO��s����CO2��g�� ��H����19 kJ��mol-1
д��FeO��s����CO��ԭ��Fe��CO2���Ȼ�ѧ����ʽ______________��
��3���Ȼ���ˮ������ӷ���ʽΪ__________ �������Ȼ�����Һʱ�μ����������������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��)���������Ƽ�ȩ(NaHSO2��HCHO��2H2O)��ӡȾ��ҽҩ�Լ�ԭ���ܹ�ҵ��Ӧ�ù㷺��
��Na2SO3��SO2��HCHO��п��Ϊԭ���Ʊ����������Ƽ�ȩ��ʵ�鲽�����£�
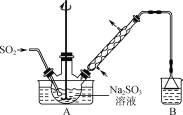
����1������ͼ��ʾװ�õ���ƿ�м���һ����Na2SO3��ˮ�������ܽ⣬����ͨ��SO2������ҺpHԼΪ4���Ƶ�NaHSO3��Һ��
����2����װ��A�е����ܻ�����Ƥ��������ƿ�м����Թ�����п�ۺ�һ������ȩ��Һ����80��90 ���£���ӦԼ3 h����ȴ�����£����ˡ�
����3������Һ�������Ũ������ȴ�ᾧ��
(1) װ��B���ձ���Ӧ�������Һ��________��
(2) ����2�м���п��ʱ��NaHSO2��Zn(OH)2���ɡ�
��д������п��ʱ������Ӧ�Ļ�ѧ����ʽ��________��
�����ɵ�Zn(OH)2�Ḳ����п�۱�����ֹ��Ӧ���У���ֹ���������Ĵ�ʩ��________��
(3) �������л�������Ҫ���ʳ�H2O�⣬����________(�ѧʽ)��
(4) ����3�д��������Ƽ�ȩ���ڳ�������������Ũ����ԭ����________��
(5) ����2�������������ijɷ�ΪZn��Zn(OH)2�����������Ʊ�ZnO��ʵ�鲽��Ϊ�������������ձ��У�________________________________________________________��900 �����ա� (��֪���� Zn����NaOH������ӦZn��2NaOH===Na2ZnO2��H2������ Zn2����ʼ������pHΪ5.9��������ȫ��pHΪ8.9��pH>11ʱ��Zn(OH)2������ZnO22����ʵ������ʹ�õ��Լ���1.0 mol��L��1 NaOH��Һ��1.0 mol��L��1 HCl��Һ��ˮ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ϊa L���ܱ������У�����2LA�����1LB���壬��һ�������·�����Ӧ��3A������+B������nC������+2D����������Ӧ��ƽ���A��Ũ�ȼ��ٵ�ԭ����![]() ����������ƽ����Է�������������
����������ƽ����Է�������������![]() ������Ӧʽ�е�nֵΪ
������Ӧʽ�е�nֵΪ
A.1B.2C.3D.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
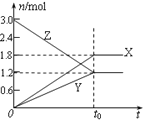
����Ŀ����һ���¶��£�������X������Y��0.16mol����10L�����ܱ������У�������Ӧ
X(g)��Y(g) ![]() 2Z(g) ��H < 0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
2Z(g) ��H < 0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
����˵����ȷ����
A����Ӧǰ2min��ƽ�����ʦ�(Z)=2.0��10��3mol��L��1��min-1
B�������������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ��(��)> ��(��)
C�����¶��´˷�Ӧ��ƽ�ⳣ��K=1.44
D�� �����������䣬�ٳ���0.2molZ��ƽ��ʱX�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С����г�������һƿijƷ��ʳ�ð״ף���Ҫ�Ǵ����ˮ��Һ������ʵ���ұ�NaOH��Һ������еζ��Բⶨ����ȷŨ�ȣ���ȫ��Ӧʱ������ҺpH����Ϊ9 ���±���4�ֳ���ָʾ���ı�ɫ��Χ��
ָʾ�� | ʯ�� | ���� | ���� | ��̪ |
��ɫ��Χ��pH�� | 5.0��8.0 | 3.1��4.4 | 4.4��6.2 | 8.2��10.0 |
��1����ʵ��Ӧѡ�� ��ָʾ����
��2����ͼ��ʾ50mL�ζ�����Һ���λ�ã���A��C�̶ȼ����1mL��A���Ŀ̶�Ϊ25���ζ�����Һ�����ӦΪ mL����Ӧ��ζ��յ�ʱ������Ϊ ��

��3��Ϊ��Сʵ������ͬѧһ������������ʵ�飬����ÿ����ȡ�״������ΪVmL��NaOH��ҺŨ��Ϊc mo1/L������ʵ������¼���£�
ʵ����� | ��һ�� | �ڶ��� | ������ |
����NaOH��Һ���/mL | 26.02 | 25.35 | 25.30 |
���ϱ����Կ�������һ��ʵ���м�¼����NaOH��Һ��������Զ��ں����Σ���ԭ������� ��
A��ʵ�����ʱ�����ӿ̶��߶�ȡ�ζ��յ�ʱNaOH��Һ�������
B���ζ�ǰ�ζ��ܼ��������ݣ��ζ��������첿�ֳ�����Һ��
C��ʢװ�״���Һ�ĵζ���������ˮϴ����δ�ð״���Һ��ϴ��
D����ƿԤ����ʳ�ð״���ϴ����
E���μ�NaOH��Һʱ��δ������տ�����Һ��ɫ������ֹͣ�ζ���
��4�������������ݣ�д������ð״��д�������ʵ���Ũ�ȵı���ʽ(���ػ���)��C�� mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��A��B���������еĵ缫��Ϊ������A���м���0.05 mol��L1��CuCl2��Һ��B���м���0.1 mol��L1��AgNO3��Һ�����е�⡣a��b��c��d�ĸ��缫�������������ʵ����ʵ���֮����

A.2��2��4��1B.1��1��2��1
C.2��1��1��1D.2��1��2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵���в���ȷ����
A. 14g��N2��13C2H2��ɵĻ�����У�����������Ϊ7NA
B. CH4�����(P4)��Ϊ��������ṹ����1mol CH4��lmolP4�������ۼ�����Ŀ��Ϊ4NA
C. ��ӦN2(g)+3H2(g)![]() 2NH3(g) ��H=-92.4kJ/mol�����ų�����4.62kJ����ת�Ƶ��ӵ���ĿΪ0.3NA
2NH3(g) ��H=-92.4kJ/mol�����ų�����4.62kJ����ת�Ƶ��ӵ���ĿΪ0.3NA
D. �����£���0.5molNH4NO3��xmolNH3��H2O��������Һ�У�����NH4+����ĿΪ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����V1mLδ֪Ũ�ȵ�NaOH��Һ��V2mL1.50mol��L��1HCl��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ��ʾ(ʵ����ʼ�ձ���V1��V2��50mL)������������ȷ���ǣ� ��
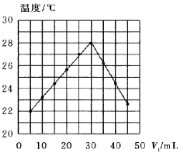
A.��ͼ��֪������ʵ��ʱ�����¶�Ϊ22��
B.��ʵ�������Ӧ�л�ѧ��ֻ��ת��Ϊ����
C.NaOH��Һ��Ũ��Լ��1.00mol��L��1
D.��ʵ�������ˮ���ɵķ�Ӧ���Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com