
图像法是研究化学反应的焓变的一种常用方法。

图1
(1)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化曲线如图1所示,判断下列叙述中正确的是________。
A.每生成2 mol AB时吸收 b kJ 热量
B.该反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键时放出a kJ能量
(2)在微生物作用的条件下,NH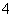 经过两步反应被氧化成NO
经过两步反应被氧化成NO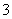 。两步反应的能量变化如图2所示:
。两步反应的能量变化如图2所示:
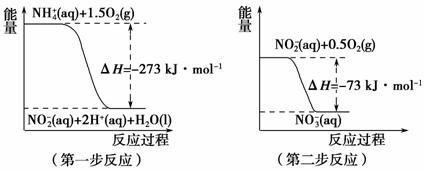
图2
1 mol NH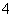 (aq)全部氧化成NO
(aq)全部氧化成NO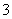 (aq)的热化学方程式是____________________________________________。
(aq)的热化学方程式是____________________________________________。
(3)图3中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素。
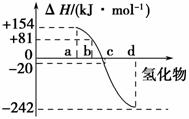
图3
①非金属元素氢化物的稳定性与氢化物生成热ΔH的关系为_______________________________________________________________。
②写出硒化氢发生分解反应的热化学方程式____________________________
_______________________________________________________________。
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
下列关于蛋白质和氨基酸的说法中,错误的是( )
A.蛋白质降解生成氨基酸属于分解反应
B.可用浓HNO3来鉴别蛋白质和淀粉
C.氨基酸既能与盐酸又能与氢氧化钠溶液反应
D.可采用渗析的方法来除去蛋白质溶液中的氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41 kJ
·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
| CO | H2O | CO2 | H2 | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中,不正确的是 ( )。
A.容器①中反应达到平衡时,CO的转化率为80%
B.容器①中CO的转化率等于容器②中CO2的转化率
C.平衡时,两容器中CO2的浓度相等
D.容器①中CO反应速率等于H2O的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)B(g)+C(g)在容积为1.0 L的密闭容器中进行,A的初始浓度为0.050 mol·L-1。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
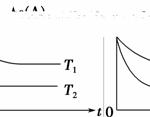
(1)上述反应的温度T1________T2,平衡常数K(T1)________K(T2)。(填“大于”、“小于”或“等于”)
(2)若温度T2时,5 min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为_______________________________________。
②反应的平衡常数K=________________________________________。
③反应在0~5 min区间的平均反应速率v(A)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在1×105Pa、298 K条件下,2 mol H2 燃烧生成水蒸气放出 484 kJ热量,下列热化学方程式正确的是 ( )。
A.H2O(g)===H2 (g) +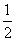 O2(g)
O2(g)
ΔH=+242 kJ·mol-1
B.2H2 (g)+O2 (g) ===2H2O(l)
ΔH=-484 kJ·mol-1
C.H2(g)+1/2O2 (g)===H2O(g)
ΔH=+242 kJ·mol-1
D.2H2(g)+O2 (g) ===2H2O (g)
ΔH=+484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
分别向1 L 0.5 mol·L-1的Ba(OH)2溶液中加入①浓硫酸、②稀硫酸、③稀硝酸,恰好完全反应时的热效应分别为ΔH1、ΔH2、ΔH3,下列关系中正确的是 ( )。
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH2<ΔH3
C.ΔH1>ΔH2=ΔH3 D.ΔH1=ΔH2<ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:常温下,0.01 mol·L-1 MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为 ( )。
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理如图1所示,其总反应式为H2+2NiOOH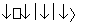 2Ni(OH)2。
2Ni(OH)2。
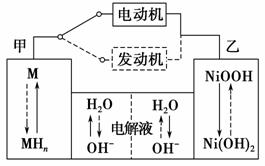
图1
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将________(填“增大”、“减小”或“不变”),该电极的电极反应式为_______________________________________________________________。
(2)图2是一种新型燃料电池,以CO为燃料,一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,图3是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。

回答下列问题:
①A极为电源________(填“正”或“负”)极,写出A极的电极反应式:________________________________________________________________。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与________极(填“C”或“D”)相连。
③当消耗标准状况下2.24 L CO时,C电极的质量变化为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨反应N2(g)+3H2(g)
 2NH3(g)在某温度下达平衡时,各物质的浓度是[N2]=3 mol·L-1,[H2]=9 mol·L-1,[NH3]=4 mol·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
2NH3(g)在某温度下达平衡时,各物质的浓度是[N2]=3 mol·L-1,[H2]=9 mol·L-1,[NH3]=4 mol·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com