
| A. | 莫言 | B. | 韩寒 | C. | 屠呦呦 | D. | 鲍勃•迪伦 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFe与足量氯气充分反应时转移的电子数为2NA | |
| B. | 18 g水中所含的电子数为10NA | |
| C. | 0.3 mol•L-1Na2SO4溶液中含0.6NA个Na+ | |
| D. | 11.2 L氮气中含NA个氮原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①④⑤ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L | B. | 2mol/L | C. | 3.2mol/L | D. | 4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精、汽车在桌面上着火时,立即用水扑灭 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应立即转移到容量瓶中定容,以减小误差 | |
| D. | 用分液漏斗分液时,下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
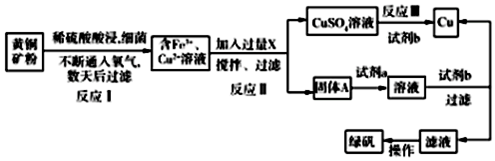
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

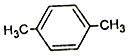 D.
D.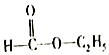
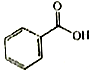 F.
F. 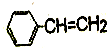 G.
G.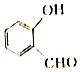
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com