
下列各物质所含原子数目,按由大到小顺序排列的是
①0.5mol NH3 ②标准状况下22.4L He ③4℃ 9mL 水 ④0.2mol H3PO4
A.①④③② B.④③②① C.②③④① D.①④②③
科目:高中化学 来源:2015-2016学年湖北武汉第二中学高二上期中考试化学试卷(解析版) 题型:选择题
某恒温密闭容器发生可逆反应:Z(?)+W(?) X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是( )
X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是( )
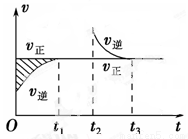
A、Z和W在该条件下均为非气态
B、t1~t2时间段与t3时刻后,两时间段反应体系中气体的
平均摩尔质量不可能相等
C、若在该温度下此反应平衡常数表达式为K=c(X),则 t1~t2时间段与t3时刻后的 X浓度不相等
X浓度不相等
D、若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建厦门一中高二上期中考试化学试卷(解析版) 题型:选择题
利尿酸在奥运会上被禁用,其结构简式如下图所示。下列叙述正确的是
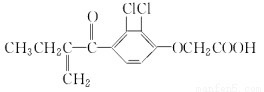
A.利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4
B.利尿酸分子内处于同一平面的原子不超过10个
C.1 mol利尿酸能与7 mol H2发生加成反应
D.利尿酸不能与溴水反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上期中测试化学试卷(解析版) 题型:选择题
在100℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,反应过程中浓度变化如下:2NO2(g)  N2O4(g) ΔH <0
N2O4(g) ΔH <0
容器 | 物质 | 起始浓度/(mol•L-1) | 平衡浓度/(mol•L-1) |
Ⅰ | N2O4 | 0.100 | 0.040 |
NO2 | 0 | 0.120 | |
Ⅱ | N2O4 | 0 | 0.014 |
NO2 | 0.100 | 0.072 |
下列说法正确的是
A. 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4)<α(NO2)
B. 平衡时,Ⅰ、Ⅱ中上述正反应的平衡常数K(Ⅰ) = 2K(Ⅱ)
C. 平衡后,升高相同温度,以N2O4表示的反应速率ν(Ⅰ)<ν(Ⅱ)
D. 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期中测试化学试卷(解析版) 题型:计算题
实验室常用的浓盐酸密度为1.17g·mL-1,质量分数为36.5%。
(1)此浓盐酸的物质的量浓度为多少?
(2)取此浓盐酸50mL,用蒸馏水稀释至200mL,稀释后盐酸的物质的量浓度为多少?
(3)将10.6gNa2CO3投入足量的上述实验所得的稀盐酸中,充分反应后,放出的CO2在标准状况下的体积为多少?将生成的CO2通入到足量澄清石灰水中,生成白色沉淀的质量为多少g?
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二上10月月考化学试卷(解析版) 题型:选择题
在密闭容器中进行反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A.Z为0.3 mol·L-1 B.Y2为0.4 mol·L-1
C.X2为0.2 mol·L-1 D.Z为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一上学期期中测试化学试卷(解析版) 题型:选择题
据中央电视台报道,近年来我国的一些沿江城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列哪种分散系
A.乳浊液 B.溶液 C.胶体 D.悬浊液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期期中(理)化学试卷(解析版) 题型:选择题
水的电离平衡曲线如图所示,下列说法不正确的是

A.图中五点KW间的关系B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可用温度不变时在水中加入适量NH4Cl固体的方法
D.若处在B点时,将pH=2的硫酸与pH=l2的KOH等体积混合后,溶液显碱性
查看答案和解析>>
科目:高中化学 来源:2016届云南省昆明市高三上学期10月摸底调研测试理综化学试卷(解析版) 题型:填空题
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
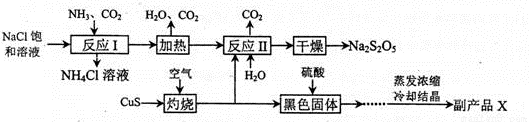
已知:反应II包含2NaHSO3=Na2S2O5+ H2O等多步反应。
(1)反应I的总化学方程式为 ,反应I进行时应先通入的气体是 ,反应I产生的NH4Cl可用作________________。
(2)灼烧时发生反应的化学方程式为 ,若灼烧时生成SO21.12×l06 L(标准状况下),则转移电子____ mol。
(3)己知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为_______________。
(4)副产品X的化学式是 ________________,在上述流程中可循环使用的物质是___________________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应II中气体与固体的物质的量之比约为 ,检验产品中含有碳酸钠杂质所需试剂________________。(填编号)。
①澄清石灰水 ②饱和碳酸氢钠溶液 ③氢氧化钠
④酸性高锰酸钾 ⑤稀硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com