
【题目】碳及其化合物有广泛的用途.
(1)反应C(s)+H2O(g)CO(g)+H2(g)△H=+131.3kJmol﹣1 , 达到平衡后,体积不变时,以下有利于提高H2产率的措施是 .
A.增加碳的用量
B.升高温度
C.用CO吸收剂除去CO
D.加入催化剂
(2)已知,C(s)+CO2(g)2CO(g)△H=+172.5kJmol﹣1则反应 CO(g)+H2O(g)CO2(g)+H2(g)△H= .
(3)CO与H2一定条件下反应生成甲醇(CH3OH),可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池负极反应式为 .
(4)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)CO2(g)+H2(g),得到如下数据:
t/min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
①其它条件不变,降低温度,达到新平衡前 v(逆)v(正)(填“>”、“<”或“=”).
②该温度下,此反应的平衡常数K=;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数
(填“增大”、“减小”或“不变”).
【答案】
(1)BC
(2)﹣41.2kJ?mol﹣1
(3)CH3OH(g)+H2O﹣6e﹣=CO2+6H+
(4)<;![]() ;不变
;不变
【解析】解:(1)A.增加碳的用量,浓度不变,平衡不移动,故错误; B.升高温度,平衡正向移动,H2产率增大,故正确;
C.用CO吸收剂除去CO,平衡正向移动,H2产率增大,故正确;
D.加入催化剂,平衡不移动,故错误;
故选:BC;(2)已知:①C(s)+H2O(g)CO(g)+H2(g),△H=+131.3kJmol﹣1 ,
②C(s)+CO2(g)2CO(g),△H=+172.5kJmol﹣1
根据盖斯定律,①﹣②得:CO(g)+H2O(g)CO2(g)+H2(g),△H=131.3kJmol﹣1﹣172.5kJmol﹣1=﹣41.2kJmol﹣1 ,
所以答案是:﹣41.2kJmol﹣1;(3)甲醇是一种燃料,可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,负极电极反应为:CH3OH6e﹣+8OH﹣═CO32﹣+6H2O
所以答案是:CH3OH(g)+H2O﹣6e﹣=CO2+6H+;(4)①正反应放热,降温时平衡正向移动,v(正)>v(逆),所以答案是:<;
②CO和H2O反应了0.06mol,则CO2和H2生成了0.06mol,平衡时各物质的浓度为:反应物CO和H2O为0.05mol/L,生成物CO2和H2为0.03mol/L,平衡常数表达式为K= ![]() =
= ![]() =
= ![]() ,所以答案是:
,所以答案是: ![]() ;
;
③反应前后气体体积不变,与原平衡等比例加入反应物,平衡与原平衡等效,所以,平衡时各物质的浓度与原判断相同,所以答案是:不变.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)),还要掌握化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%)的相关知识才是答题的关键.


科目:高中化学 来源: 题型:
【题目】密闭容器中加入4molA、1.2molC和一定量的B三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知t0~t1阶段保持恒温、恒容,且c(B)未画出].乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件,其中t3时刻为使用催化剂. 
(1)若t1=15s,则t0~t1阶段的反应速率为v(C)= .
(2)t4时刻改变的条件为 , .
(3)已知t0~t1阶段该反应放出或吸收的热量为Q kJ(Q 为正值),试写出该反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去括号内杂质所用试剂和方法,正确的是
A. 溴苯(液溴): KOH溶液分液B. 乙烯(SO2):酸性KMnO4溶液洗气
C. 乙烷(乙烯): H2(催化剂)催化加氢D. 乙醇(水):分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )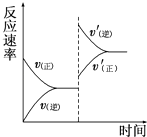
A.正反应是吸热反应
B.逆反应是放热反应
C.m+n<p+q
D.m+n>p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等). 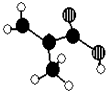
(1)该产品的结构简式为;
(2)下列物质中,与该产品互为同分异构体的是(填序号),与该产品互为同系物的是(填序号).
①CH3CH=CHCOOH ②CH2=CHCOOCH3 ③CH3CH2CH=CHCOOH ④CH3CH(CH3)COOH
(3)在一定条件下,该产品跟乙二醇反应可得到分子式为C6H10O3的物质,该物质发生加聚反应可得到用来制作隐形眼镜的高分子材料,这种高聚物的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.10g镁铝合金加入120mL4.0molL﹣1的盐酸中,待合金完全溶解后,得到溶液X.下列说法一定正确的是( )
A.合金完全溶解后产生的H2的物质的量为0.24mol
B.合金中的镁与铝的物质的量之比小于1
C.若向溶液X中加入270mL2.0molL﹣1NaOH溶液,充分反应,所得沉淀为Mg(OH)2
D.若向溶液X中加入足量的氨水,充分反应,所得沉淀经过过滤、洗涤后充分灼烧,则残留固体质量大于8.50g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为铁制品循环利用的示意图,根据图示回答:
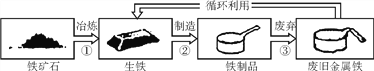
(1)从“①”“②”“③”中,选出一定发生化学变化的是____(填序号)。
(2)不能用铁制容器盛放硫酸铜溶液的原因是_____________ (用化学方程式表示)。
(3)废旧金属“循环利用”的意义是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明将未经砂纸打磨的铝条放入盛有足量稀盐酸的密闭容器中,用压强传感器测得容器内气体压强——反应时间的变化曲线如下图所示。
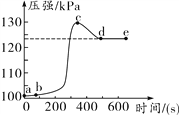
回答下列问题:
(1)ab段发生反应的化学方程式是______________。
(2)bc段发生反应的化学方程式是______________。
(3)cd段压强变化的主要原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL 0.25 mol·L-1的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是( )
A.3.45 gB.2.3 gC.1.15 gD.0.575 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com