
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
分析 根据该元素所在的周期和族可知:①为H、②为He、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl元素,据此结合元素周期律知识进行解答.
解答 解:根据该元素所在的周期和族可知:①为H、②为He、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl元素,
(1)10种元素中,能够形成共价键的元素有:①为H、③为C、④为N、⑤为O、⑥为F、⑨为S、⑩为Cl元素,
故答案为:H、C、N、O、F、S、Cl;
(2)只需形成一个共价单键就能达到稳定结构,说明该元素的最外层含有1个或7个电子,满足条件的元素有:H、Cl、F,
故答案为:H、F、Cl.
点评 本题考查了元素周期表和元素周期律的综合应用,题目难度不大,熟练掌握元素周期表结构、元素周期律的内容即可解答,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 室温下,在水中的溶解度:丙烷>乙二醇>乙醇 | |
| B. | 可用碘水和银氨溶液鉴别葡萄糖、麦芽糖和淀粉三种物质 | |
| C. | 油脂和蛋白质均为能发生水解反应的高分子化合物 | |
| D. | 聚碳酸酯 中含有 中含有 结构 结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,反应类型为加聚反应.
,反应类型为加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:R<Y<Z | B. | 简单氢化物的热稳定性:R>Y | ||
| C. | R与Y只能形成一种化合物 | D. | 最高价氧化物的水化物酸性:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
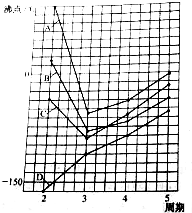 图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素气态氢化物的沸点.其中表示ⅥA族元素气态氢化物沸点的是曲线A,表示ⅣA族元素气态氢化物沸点的是曲线D;同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,其原因是同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.
图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素气态氢化物的沸点.其中表示ⅥA族元素气态氢化物沸点的是曲线A,表示ⅣA族元素气态氢化物沸点的是曲线D;同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,其原因是同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
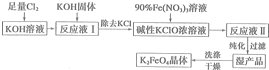

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com