
| A. | 将少量SO2气体这入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HCLO | |
| B. | 向KHSO4溶液中加入Ba(OH)2溶液的pH=7:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 向Ca(H2PO4)2溶液中滴入过量的NaOH溶液:3Ca2++6H2PO4-+12OH-═Ca3(PO4)2↓+12H2O+$4PO_{4}^{-}}$ | |
| D. | 112mL(S.T.P)Cl2通入10ml1mol/L的FeBr2溶液:2Fe2++4Br-+3CL2═2Fe3++6Cl-+2Br2 |
分析 A.次氯酸根离子能够将亚硫酸根离子离子氧化成硫酸根离子;
B.溶液为中性时,硫酸氢钾与氢氧化钡按照物质的量2:1反应;
C.氢氧化钠过量,反应生成磷酸钙、磷酸钠和水;
D.先判断过量情况,亚铁离子的还原性大于溴离子,则亚铁离子优先反应.
解答 解:A.少量二氧化硫通入次氯酸钠溶液中,二氧化硫被氧化成硫酸根离子,正确的反应为:SO2+3ClO-+H2O=SO42-+2HClO+Cl-,故A错误;
B.向KHSO4溶液中加入Ba(OH)2溶液的pH=7,硫酸氢钾与氢氧化钡的物质的量之比为2:1,正确的反应为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故B错误;
C.向Ca(H2PO4)2溶液中滴入过量的NaOH溶液的离子方程式为:3Ca2++6H2PO4-+12OH-═Ca3(PO4)2↓+12H2O+4PO4-,故C正确;
D.根据还原性Fe2+>Br-可知,通入氯气先发生反应:2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-;标况下112mL氯气的物质的量为:n(Cl2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,10mL1mol/L的FeBr2溶液中含有溶质溴化亚铁的物质的量为:n(FeBr2)=1mol/L×0.01L=0.01mol,含有亚铁离子的物质的量为0.01mol,溴离子的物质的量为0.02mol;根据反应2Fe2++Cl2═2Fe3++2Cl-可知,0.01mol亚铁离子完全反应消耗0.005mol氯气,氯气完全反应,溴离子没有被氧化,则反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | K3C60的摩尔质量是837 | |
| B. | 1 mol K3C60中含有的离子数目为63×6.02×1023 | |
| C. | 该晶体在熔融状态下能导电 | |
| D. | 该物质的化学式可写为KC20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的结构简式为-COH | |
| B. | 乙烯和乙醇都能使溴水和酸性KMnO4溶液褪色 | |
| C. | 乙酸乙酯中的官能团为酯基(-COO-),能发生水解反应 | |
| D. | 苯能与氢气发生加成反应,是因为苯分子中含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
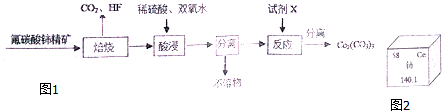
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
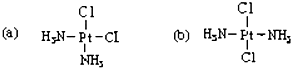 科学家发现铂的两种化合物(如图)有不同的特性,a 具有抗癌作用,而 b 没有.则 a 和 b 属于 ( )
科学家发现铂的两种化合物(如图)有不同的特性,a 具有抗癌作用,而 b 没有.则 a 和 b 属于 ( )| A. | 同分异构体 | B. | 同素异形体 | C. | 同位素 | D. | 同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9mol•L-1 | B. | 6mol•L-1 | C. | 3mol•L-1 | D. | 2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
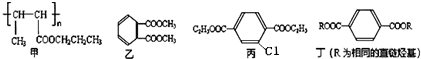
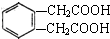 ;
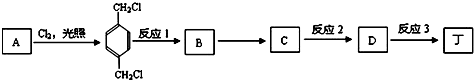
;
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 决定化学反应速率的主要因素是反应物的浓度、压强、温度、催化剂等 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸的起始温度.NaOH溶液的起始温度和反应后反应体系的最高温度 | |
| C. | 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 | |
| D. | 某可逆反应的化学平衡常数K,只随温度的改变而改变,且温度越高K值一定越大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com