
| A. | BaCl2+K2SO4═BaSO4↓+2KCl | B. | BaCO3+H2SO4═BaSO4↓+CO2↑+H2O | ||
| C. | Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 | D. | Ba(OH)2+2KHSO4═BaSO4↓+K2SO4+2H2O |
分析 Ba2++SO42-═BaSO4↓表示氢氧化钡或者可溶性钡盐与可溶性硫酸盐或者可溶性硫酸氢盐反应只生成硫酸钡一种沉淀的反应,据此解答.
解答 解:A.BaCl2+K2SO4═BaSO4↓+2KCl,离子方程式为:Ba2++SO42-═BaSO4↓,故A不选;
B.BaCO3+H2SO4═BaSO4↓+CO2↑+H2O,离子方程式:BaCO3+2H++SO42-=BaSO4↓+CO2↑+H2O,不能用Ba2++SO42-═BaSO4↓表示,故B选;
C.Ba(NO3)2+H2SO4═BaSO4↓+2HNO3反应的离子方程:Ba2++SO42-═BaSO4↓,故C不选;
D.Ba(OH)2+2KHSO4═BaSO4↓+K2SO4+2H2O反应的离子方程式:2OH-+2H++Ba2++SO42-═BaSO4↓+2H2O,故D选;
故选:BD.
点评 本题考查离子反应方程式的书写,题目难度中等,明确发生的化学反应即可解答,熟悉常见物质的溶解性是解答的关键,注意掌握离子方程式与化学方程式表示的意义.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:填空题
| 装置 | 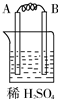 甲 甲 | 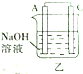 | 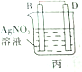 | 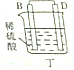 |
| 现象 | A不断溶解 | A极有气泡产生 | B电极质量增加 | B、D电极均无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
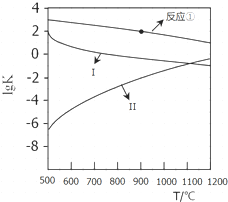 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
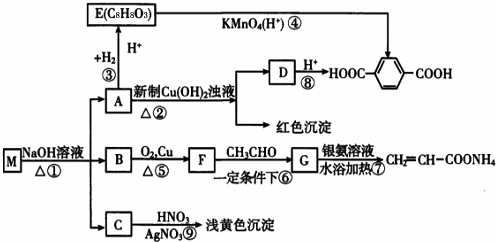
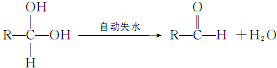
 ;E:
;E: ;G:CH2=CHCHO.
;G:CH2=CHCHO. .
. (写一种).
(写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为SiO2 | B. | 熔化时共价键断裂 | ||
| C. | 属于酸性氧化物 | D. | 1mol SiO2中含有4 mol Si-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
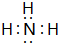 ;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)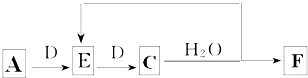
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3 与Fe3O4互为同素异形体 | |
| B. | 检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 | |
| C. | 将CO2通入BaCl2溶液中至饱和,有沉淀产生 | |
| D. | 制备Al用电解法,制备Fe、Cu可用还原法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com