
【题目】苹果酸的结构简式为![]() ,下列说法错误的是( )
,下列说法错误的是( )
A.1mol苹果酸可与2molNaOH发生中和反应
B.一定条件下,苹果酸与乙酸或乙醇均能发生酯化反应
C.![]() 与苹果酸互为同分异构体
与苹果酸互为同分异构体
D.1mol苹果酸与足量金属Na反应生成1.5molH2
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G是周期表中短周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 其一种单质可吸收紫外线,是地球的保护伞 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
(1)B元素符号为___,G的元素名称为___,它的一种同位素可测定文物年代,这种同位素的符号是___。
(2)A与C以原子个数比为1:1形成的一种化合物,其所属化合物类型为___(填“离子化合物”或“共价化合物”),包含的化学键有__(填“离子键”、“极性共价键”或“非极性共价键”)。
(3)F常温下可以形成两种用途广泛的氢化物,它们的电子式分别为__和__,并用电子式表示出其最简单气态氢化物的形成过程___。
(4)D在元素周期表中的位置__,D与E相比非金属性较强的是__(填元素名称),请从原子结构的角度解释原因:__。
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]是强碱,常温下甲胺(CH3NH2·H2O)的电离常数为Kb,且pKb=-lgKb =3.38。常温下,在体积均为20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液和甲胺溶液,分别滴加浓度为0.1mol·L-1的盐酸,溶液的导电率与盐酸体积的关系如图所示。下列说法正确的是
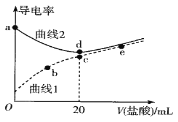
A. 曲线1代表四甲基氢氧化铵溶液
B. 在b、c、e三点中,水的电离程度最大的点是e
C. b点溶液中:c(Cl-)=c(CH3NH3+)+c(CH3NH2·H2O)
D. 常温下,CH3NH3Cl水解常数的数量级为10-11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)海洋是地球上碳元素的最大吸收池。
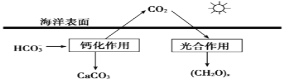
①溶于海水中的CO2主要以四种无机碳形式存在,即:CO2、H2CO3、___________、___________。
②在海洋碳循环中,可通过如上图所示的途径固碳。写出钙化作用的离子方程式___________。
(2)过量CO2溶解于海水将使许多海洋生物面临巨大威胁。研究者提出,用下图所示方法从海水中提取CO2,可以降低环境温室气体CO2的含量。
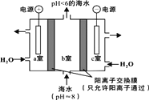
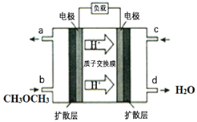
① a室的电极反应式是__________;
② 利用该装置产生的物质X可处理b室排出的海水,获得可排回大海的合格海水,X的化学式是__________。
(3)已知:NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。所得溶液的pH___________7(填“>”、“=”或“<”)。烟气需冷却至15.5℃~26.5℃的可能原因是____________。
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。往吸收液中滴加1.0mol/L盐酸,生成的V(CO2)随V(盐酸)变化关系如图所示,则原吸收液中离子浓度由大到小的顺序为__________。
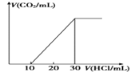
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种新兴化工原料,具有甲基化反应性能。
I.二甲醚的生产:二甲醚的生产原理之一是利用甲醇脱水成二甲醚,化学方程式如下:
反应i 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) ΔH 1
CH3OCH3(g) + H2O(g) ΔH 1
(1)已知:甲醇、二甲醚的气态标准燃烧热分别为-761.5 kJ·mol-1、-1455.2 kJ·mol-1,且H2O(g) = H2O(l) ΔH=﹣44.0 kJ·mol﹣1。则反应i的ΔH 1=_________kJ·mol﹣1.
(2)反应i中甲醇转化率、二甲醚选择性的百分率与不同催化剂的关系如下表所示,生产时,选择的最佳催化剂是_________。
催化剂 | 甲醇转化率/% | 二甲醚选择性/% |
SiO2-TiO2/SO42- | 35.1 | 98.1 |
SiO2-TiO2/Fe3+ | 52.9 | 98.7 |
GSAL-108 | 81.0 | 98.1 |
SiO2-Al2O3 | 62.1 | 96.4 |
注:反应条件:常压、温度270℃,甲醇液体空速14mL/(g·h)
(3)选定催化剂后,测得平衡时的甲醇转化率与温度的关系如图所示。经研究产物的典型色谱图发现该过程主要存在的副反应为:
反应ii 2CH3OH(g) ![]() C2H4 (g)+2H2O(g) ΔH2=﹣29.1kJ·mol﹣1
C2H4 (g)+2H2O(g) ΔH2=﹣29.1kJ·mol﹣1
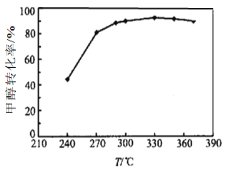
① 工业上生产二甲醚的温度通常在270-300℃,高于330℃之后,甲醇转化率下降。
根据化学平衡移动原理分析其原因可能是_________;
根据化学反应速率变化分析其原因可能是_________。
② 某温度下,以CH3OH(g)为原料,平衡时各物质的分压数据如下表:
物质 | CH3OH(g) | CH3OCH3(g) | C2H4 (g) | H2O(g) |
分压/MPa | 0.16 | 0.288 | 0.016 | … |
则反应i中,CH3OH(g)的平衡转化率α=_________。(用平衡分压代替平衡浓度计算;结果保留两位有效数字。)
II.二甲醚的应用:
(4)下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。该电池的负极反应式为:_________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以苯甲酸和异丙醇为原料,制取苯甲酸异丙酯(![]() ),已知有关物质的沸点如表:
),已知有关物质的沸点如表:

在如图圆底烧瓶中加入12.2g苯甲酸和30mL异丙醇(密度约为0.79g/cm3),再小心加入3mL浓硫酸,混匀后,加入几块碎瓷片,小心加热30分钟,使反应充分,得苯甲酸异丙酯粗产品。
![]()
(1)加入碎瓷片的作用是______,加入浓硫酸的作用是_____;
(2)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学反应方程式:_______;
(3)苯甲酸异丙酯粗产品中往往含有少量异丙醇、苯甲酸和水等,现拟用下列流程图进行精制,操作①中用到的一种重要玻璃仪器是_________;操作②的名称是__________。
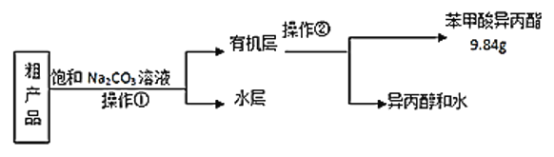
(4)在进行操作②收集苯甲酸异丙酯时应控制的温度范围_______。
A.80℃~100℃ B.200℃~249℃ C.217℃~219℃ D.249℃以上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明:H2O2具有立体结构,两个氢原子像在一本半展开的书的两页纸上,两页纸面的夹角为94°,氧原子在书的夹缝上,O—H键与O—O键之间的夹角为97°。下列说法不正确的是( )
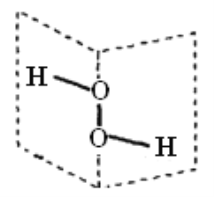
A. H2O2分子中既含极性键,又含非极性键
B. H2O2为极性分子
C. H2O2分子中的两个O原子均是sp3杂化
D. H2O2分子中既有σ键,又有π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2A(g)+3B(g)![]() 4C(g),下列各数据表示不同条件下的化学反应速率,其中反应进行得最快的是
4C(g),下列各数据表示不同条件下的化学反应速率,其中反应进行得最快的是
A.υ(C)=3.6mol/(L·min)B.υ(B)=0.04mol/(L·s)
C.υ(B)=0.9mol/(L·min)D.υ(A)=1.6mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B都是芳香族化合物,1摩尔A水解得到1摩尔B和1摩尔醋酸。A、B的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O,且B分子中碳和氢元素总的质量百分含量为65.2%。A的溶液具有酸性,不能使FeCl3溶液显色。
(1)A、B的分子量之差为____________
(2)A的分子式是___________________
(3)B可能的三种结构简式是____________ 、_____________ 、__________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com