
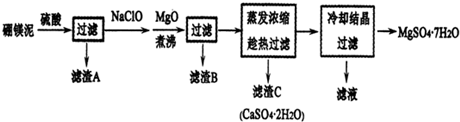
分析 硼镁泥主要成份是MgO,还有CaO、Al2O3、Fe2O3、FeO、MnO、B2O3、SiO2等杂质,加入硫酸,MgO、CaO、Al2O3、Fe2O3、FeO、MnO、B2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,加MgO调节pH,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤,滤渣B含有Fe(OH)3、Al(OH)3、MnO2,蒸发浓缩滤液,趁热过滤,滤渣C为硫酸钙晶体,滤液中含镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体.
(1)二氧化硅与氢氟酸反应生成四氟化硅和水;
(2)根据流程分析判断;加MgO调节pH除去铁离子和铝离子;
(3)NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,溶液中含有Fe2+,具有还原性,可与NaClO发生氧化还原反应;
(4)温度较高时硫酸镁不会析出;
(5)H3BO3与NaOH溶液反应生成Na2B4O7•lOH2O;Na2B4O7•lOH2O与金属钠、氢气及二氧化硅反应生成NaBH4和硅酸钠.
解答 解:(1)滤渣A的成分是二氧化硅,二氧化硅与氢氟酸反应生成四氟化硅和水,其反应方程式为:SiO2+4HF=SiF4↑+2H2O;
故答案为:SiO2+4HF=SiF4↑+2H2O;
(2)由流程分析可知,滤渣B含有的成分有Fe(OH)3、Al(OH)3、MnO2;加MgO调节pH,铁离子水解生成氢氧化铁沉淀,铝离子水解形成氢氧化铝沉淀,从而除去溶液中的铁离子和铝离子;
故答案为:Fe(OH)3、Al(OH)3、MnO2;调节pH,促进Al3+、Fe3+完全水解生成氢氧化物沉淀而除去;
(3)NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,溶液中含有Fe2+,具有还原性,可与NaClO发生氧化还原反应,反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,
故答案为:Mn2++ClO-+H2O═MnO2↓+2H++Cl-;2Fe2++ClO-+2H+═2Fe3++Cl-+H2O;
(4)温度较高时硫酸镁溶解度较大,硫酸钙的溶解度较小,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙,可以防止硫酸镁在温度降低时结晶析出;
故答案为:防止硫酸镁在温度降低时结晶析出;
(5)H3BO3与NaOH溶液反应生成Na2B4O7•lOH2O,其反应方程式为:4H3BO3+2NaOH+3H2O=Na2B4O7•lOH2O;Na2B4O7•lOH2O与金属钠、氢气及二氧化硅反应生成NaBH4和硅酸钠,反应方程式为:Na2B4O7•lOH2O+16Na+8H2+7SiO2=4NaBH4+7Na2SiO3;
故答案为:4H3BO3+2NaOH+3H2O=Na2B4O7•lOH2O;Na2B4O7•lOH2O+16Na+8H2+7SiO2=4NaBH4+7Na2SiO3.
点评 本题考查物质制备工艺流程,为高考常见题型,涉及物质的分离与提纯、对原理与条件控制分析、盐类水解等,关键是对工艺流程理解,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 蛋白质属于天然有机高分子化合物,没有蛋白质就没有生命 | |
| B. | HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性 | |
| C. | 某些蛋白质跟浓硝酸作用会变黄 | |
| D. | 可以采用多次盐析或多次渗析的方法分离、提纯蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3NO2+H2O═2HNO3+NO | B. | 4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2 | ||
| C. | 3Cl2+8NH3═N2+6NH4Cl | D. | 2Na+2NH3(液)═2NaNH2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
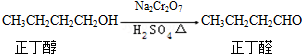
| 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
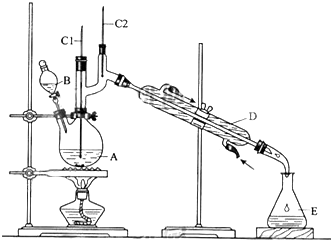
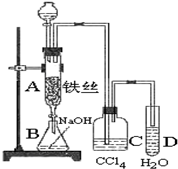 实验室用图装置制取少量溴苯,试填写下列空白.
实验室用图装置制取少量溴苯,试填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡需加热的反应是吸热反应 | B. | 只有分解反应才是吸热反应 | ||
| C. | 使用催化剂的反应是吸热反应 | D. | 氧化还原反应不一定是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com