
Cu2(OH)2CO3 2A+CO2↑+H2O,反应中物质A的化学式为( )
2A+CO2↑+H2O,反应中物质A的化学式为( )
|
| A. | Cu(OH)2 | B. | Cu | C. | CuO | D. | Cu2O |
科目:高中化学 来源: 题型:
现有常温下的六份溶液:
①0.01mol • L﹣1 CH3COOH溶液;
②0.01mol • L﹣1 HCl溶液;
③pH=12的氨水;
④ pH=12的NaOH溶液;
⑤0.01mol • L﹣1 CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01mol • L﹣1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是________(填序号,下同),水的电离程度相同的是________。
(2)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②________③(填“>”“<”或“=“)。
(3)将六份溶液同等稀释10倍后,溶液的pH:①________②,③________④,⑤________⑥(填“>”“<”或“=“)。
(4)将①④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈________(填序号)。
A.酸性 B.碱性 C.中性
查看答案和解析>>
科目:高中化学 来源: 题型:
具有下列电子排布式的原子中,半径最大的是( )
|
| A. | 1s22s22p63s23p3 | B. | 1s22s22p3 |
|
| C. | 1s22s22p2 | D. | 1s22s22p63s23p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如表为长式周期表的一部分,其中的序号代表对应的元素.
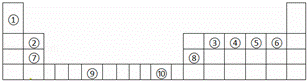
(1)写出上表中元素⑤的轨道表示式 ,元素⑨原子的核外电子排布式 .
(2)元素第一电离能的大小比较:④ ⑤(填写“>”“=”或“<”,下同);元素电负性的大小比较:④ ⑤(填写“>”“=”或“<”);请写出与元素④的单质互为等电子体的一种微粒的化学式 .
(3)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是 .
(4)上述③与④元素组成的(CN)2化合物中σ键与π键之比 .
(5)⑦的氧化物是优良的耐高温材料,它的熔点比CaO高,其原因是 .
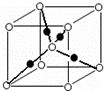
(6)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则该氧化物的化学式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
铋(Bi)在医药方面有重要应用.下列关于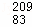 Bi和
Bi和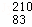 Bi的说法正确的是( )
Bi的说法正确的是( )
|
| A. |
|
|
| B. |
|
|
| C. |
|
|
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分子中既有σ键,又有π键的是( )
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2.
|
| A. | ①②③ | B. | ③④⑤⑥ | C. | ①③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com