
【题目】茉莉花香气成分有多种,乙酸苯甲酯(![]() )是其中一种,它可以从茉莉花中提取,也可用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中一种,它可以从茉莉花中提取,也可用甲苯和乙醇为原料进行人工合成。一种合成路线如下:

(1)B的结构简式分别为___;反应⑤的反应类型分别为___。
(2)写出反应①、③的化学方程式:
①____;
③____。
(3)反应___(填序号)原子的理论利用率为100%,符合“绿色化学”的要求。
(4)符合下列条件的乙酸苯乙酯的同分异构体的数目有___个
I、能发生银镜反应 II、能发生水解反且水解产物能与FeCl3溶液发生显色反应。
【答案】CH3COOH 取代反应(水解反应) 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O  +CH3COOH
+CH3COOH +H2O ② 9
+H2O ② 9
【解析】
由合成流程可知,乙醇在Cu或Ag催化作用下加热反应生成CH3CHO(A),CH3CHO继续被氧化为CH3COOH(B),甲苯光照下发生取代反应生成![]() ,
,![]() 在碱性条件下水解生成C为
在碱性条件下水解生成C为![]() ,在一定条件下与CH3COOH发生酯化反应生成
,在一定条件下与CH3COOH发生酯化反应生成![]() ,然后结合有机物的结构和性质解答该题。
,然后结合有机物的结构和性质解答该题。
乙醇在Cu作催化剂、加热条件下发生氧化反应生成A为CH3CHO,CH3CHO进一步被氧化生成B为CH3COOH,甲苯与氯气发生取代反应生成![]() ,
,![]() 在碱性条件下水解生成C为
在碱性条件下水解生成C为![]() ,苯甲醇与乙酸在一定条件下发生酯化反应生成
,苯甲醇与乙酸在一定条件下发生酯化反应生成![]() ,反应 ⑤是氯代烃的水解,属于取代反应,或是水解反应。
,反应 ⑤是氯代烃的水解,属于取代反应,或是水解反应。
(1)C的结构简式为:![]() ,
,
故答案为:![]() ;取代反应或水解反应;
;取代反应或水解反应;
(2)反应①是乙醇发生催化氧化生成乙醛,反应化学方程式为:![]() ,
,
故答案为:![]() ;
;
③是B和C反应生成乙酸苯甲酯,属于酯化反应,酸失去羟基,醇失去羟基上的氢,生成酯: +CH3COOH
+CH3COOH +H2O ,
+H2O ,
答案为: +CH3COOH
+CH3COOH +H2O;
+H2O;
(3)化合反应的原子利用率是百分之一百,符合“绿色化学”的要求。①②③④⑤这五个反应中,①是醇氧化成醛,还生成了水,不属于化合反应,原子利用率不是百分之一百,故①错误;
②是醛氧化成酸,属于化合反应,原子利用率是百分之一百,故②正确;
③是酯化反应,是取代反应,不属于化合反应,原子利用率不是百分之一百,故③错误;
④是取代反应,不属于化合反应,原子利用率不是百分之一百,故④错误;
⑤是卤代烃的水解反应,是取代反应,原子利用率不是百分之一百,故⑤错误;
故答案选②。
(4)乙酸苯甲酯的分子式为C9H10O2,同分异构体满足能发生银镜反应,能发生水解反应且水解产物能与

 共9种,
共9种,
答案为:9。


科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库,醢藏着丰富的化学元素,如氯、溴、碘等,海洋资源的综合利用具有非常广阔的前景。
(1)下列说法正确的是_________。
a.AgCl、AgBr、AgI的颜色依次变深 b.F、Cl、Br、I的非金属性依次增强
c.HF、HCl、HBr、HI的还原性的依次增强 d.F2、Cl2、Br2、I2与H2化合由难变易
(2)实验室从海藻灰中提取少量碘的流程如下图:
![]()
①氧化时,可以加入MnO2在酸性条件下进行氧化,反应的离子方程式为:_________。
②上述步骤①②③分离操作分别为过滤、_________、_________。
(3)从海水提取的粗盐中含有Mg2+、Fe2+、Ca2+和SO42—等杂质,“除杂”所需试剂有:①过量的NaOH溶液②过量的Na2CO3溶液③适量的盐酸④过量的BaCl2溶液.试剂的添加顺序为_________。
为使Ca2+完全沉淀,溶液中c(CO32—)应不小于_________mol/L。[已知Ksp(CaCO3)=2.9×10-9,离子浓度小于1×10-5mol/L视为完全沉淀]
(4)目前,利用食盐制取纯碱主要有“氨碱法”和“联合制碱法”两种工艺
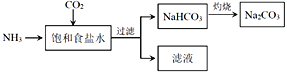
①能析出 NaHCO3的原因是_________。
②“氨碱法”是在滤液中加入_________产生NH3,循环使用,但产生大量的度弃物CaCl2;“联合制碱法“是在滤液中继续通入NH3,并加入NaCl粉末以制得更多的副产物_________。
③常温下,向饱和食盐水中通入NH3和CO2,当(HCO3—)=c(NH4+)时,溶液的pH_____7 (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参照反应Br+H2 ![]() HBr+H的反应历程示意图,下列叙述中正确的是
HBr+H的反应历程示意图,下列叙述中正确的是
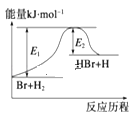
A. 该反应的反应热△H=E2﹣E1
B. 正反应为吸热反应
C. 吸热反应一定要加热后才能发生
D. 升高温度可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,TiSCN在水中的沉淀溶解平衡曲线如图所示。已知:p(Ti+)=-lgc(Ti+),p(SCN-)=-lgc(SCN-)。下列说法正确的是
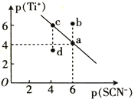
A.该温度下,Ksp(TiSCN)=1.0×10-24
B.a点的Ksp(TiSCN)小于b点的Ksp(TiSCN)
C.d点表示的是该温度下TiSCN的不饱和溶液
D.加入TiCl(易溶于水)可以使溶液由c点变到a点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属与硝酸的反应,实验如下。
实验 (20C) | 现象 |
Ⅰ | 无色气体(遇空气变红棕色),溶液变为蓝色 |
Ⅱ | 6mL无色气体(经检测为H2),溶液几乎无色 |
⑴Ⅰ中产生的无色气体是______。
⑵研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于NO3-,所以NO3-没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是______。
![]() 乙同学通过分析,推测出NO3-也能被还原,依据是______,进而他通过实验证实该溶液中含有NH4+,其实验操作是______。
乙同学通过分析,推测出NO3-也能被还原,依据是______,进而他通过实验证实该溶液中含有NH4+,其实验操作是______。
![]() 补全Ⅱ中NO3-被还原为
补全Ⅱ中NO3-被还原为![]() 的过程:NO3- + ______e- + ______= NH4+ + ______H2O
的过程:NO3- + ______e- + ______= NH4+ + ______H2O
⑶研究影响产生H2的因素
实验 | 现象 |
Ⅲ | 3.4m L气体(经检测为H2),溶液略带黄色 |
Ⅳ | 2.6m L气体(经检测为H2),黄色溶液 |
Ⅴ | 无色气体(遇空气变红棕色),深棕色溶液 |
资料:Fe[(NO)]2+在溶液中呈棕色。 ④对比Ⅱ、Ⅲ、Ⅳ,温度不同时收集到氢气的体积不同,原因是______。 ⑤Ⅴ中无色气体是混合气体,则一定含有遇空气变红棕色的气体和______。 ⑷根据实验,金属与硝酸反应时,影响硝酸的还原产物不同的因素有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭烧瓶中充满NO2,在25℃时NO2与N2O4达到平衡:2NO2![]() N2O4ΔH﹤0,把烧瓶置于100℃沸水中,又建立新的平衡状态,前后两平衡比较,不变的是
N2O4ΔH﹤0,把烧瓶置于100℃沸水中,又建立新的平衡状态,前后两平衡比较,不变的是
A.颜色B.平均分子量C.物质的量D.密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,分别向20.00 mL 0.100 0 mol·L-1的氨水、醋酸铵溶液中滴加0.100 0 mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法错误的是( )
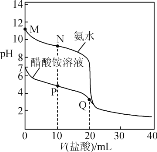
A.氨水的电离平衡常数的数量级约是10-5
B.N点:c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)
C.P点:c(NH4+)<2c(CH3COO-)+c(NH3·H2O)
D.Q点:2c(Cl-)=c(CH3COOH)+c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 3d3表示3d能级上有3个轨道
B. ns能级的原子轨道图都可以用如图表示
C. 1s电子云呈球形,表示电子绕原子核做圆周运动
D. 电子云图的黑点密度越大,说明核外空间电子数越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)请写出元素o的基态原子电子排布式__________________________________。
(2)d的氢化物的分子构型为____________,中心原子的杂化形式为________;k在空气中燃烧产物的分子构型为________,中心原子的杂化形式为________,该分子是________(填“极性”或“非极性”)分子。
(3)第三周期8种元素按单质熔点高低的顺序排列如图,其中序号“8”代表________(填元素符号);其中电负性最大的是________(填图中的序号)。

(4)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是________,试从结构角度加以解释______________。
(5)i单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。

甲 乙 丙
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
②该晶体的密度为________(用字母表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com