
【题目】CO2是地球上取之不尽用之不竭的碳源,捕集、利用 CO2 始终是科学研究的热点。
⑴新的研究表明,可以将 CO2 转化为炭黑回收利用,反应原理如图所示。
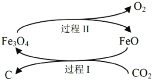
①整个过程中 FeO 的作用是_____________;
②写出 CO2 转化为炭黑的总反应化学方程式_____________。
⑵由CO2 合成甲醇是CO2资源化利用的重要方法。
研究表明在催化剂作用下CO2 和H2可发生反应:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH
CH3OH(g) + H2O(g) ΔH
①有利于提高合成CH3OH反应中CO2的平衡转化率的措施有_______。(填字母)
a.使用催化剂 b.加压 c.增大初始投料比n(CO2 )/ n(H2)
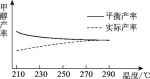
②研究温度对于甲醇产率的影响。在210 ℃~290 ℃,保持原料气中CO2和H2的投料比不变,得到甲醇的实际产率、平衡产率与温度的关系如下图所示。ΔH____0(填“>”或“<”),其依据是_______。
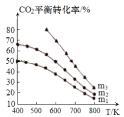
⑶工业用二氧化碳加氢可合成乙醇:![]() 保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比
保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比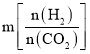 的关系如图所示。
的关系如图所示。
①该反应平衡常数的表达式为_________________。
②投料比m1、m2、m3由大到小的顺序为 _________________。
【答案】催化剂 CO2  C+O2 b < 温度升高,甲醇的平衡产率降低,平衡逆向移动,则逆向是吸热反应,正向放热反应
C+O2 b < 温度升高,甲醇的平衡产率降低,平衡逆向移动,则逆向是吸热反应,正向放热反应 ![]() m3 > m2> m1
m3 > m2> m1
【解析】
⑴①FeO参与了化学反应但FeO的量没有变化;②根据图像分析CO2反应。
⑵①a.使用催化剂,平衡不移动,转化率不变;b.该反应是体积减小的反应,加压,平衡正向移动,CO2的平衡转化率增大;c.增大初始投料比n(CO2)/n(H2),可以理解为n(H2)不变,n(CO2)增大,平衡正向移动,但CO2的平衡转化率减小;②升高温度,甲醇的平衡产率降低,平衡逆向移动,则逆向是吸热反应,正向放热反应,即ΔH<0;故答案为:<;温度升高,甲醇的平衡产率降低,平衡逆向移动,则逆向是吸热反应,正向放热反应。
⑶①根据反应方程式书写平衡常数表达式;②投料比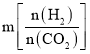 ,理解为n(CO2)不变,n(H2)增大,平衡正向移动,CO2的平衡转化率增大。
,理解为n(CO2)不变,n(H2)增大,平衡正向移动,CO2的平衡转化率增大。
⑴①FeO在反应过程中参与了化学反应,但FeO的量没有变化,因此FeO的作用是催化剂;故答案为:催化剂。
②FeO和CO2反应生成C和Fe3O4,Fe3O4反应生成FeO和O2,因此CO2转化为炭黑的总反应化学方程式CO2 C+O2;故答案为:CO2
C+O2;故答案为:CO2 C+O2。
C+O2。
⑵①a.使用催化剂,平衡不移动,转化率不变,故a不符合题意;b.该反应是体积减小的反应,加压,平衡正向移动,CO2的平衡转化率增大,故b符合题意;c.增大初始投料比n(CO2)/n(H2),可以理解为n(H2)不变,n(CO2)增大,平衡正向移动,但CO2的平衡转化率减小,故c不符合题意;综上所述,答案为b。
②升高温度,温度升高,甲醇的平衡产率降低,平衡逆向移动,则逆向是吸热反应,正向放热反应,即ΔH<0;故答案为:<;升高温度,温度升高,甲醇的平衡产率降低,平衡逆向移动,则逆向是吸热反应,正向放热反应。
⑶①该反应平衡常数的表达式为![]() ;故答案为:
;故答案为:![]() 。
。
②投料比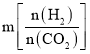 ,理解为n(CO2)不变,n(H2)增大,平衡正向移动,CO2的平衡转化率增大,因此投料比m1、m2、m3由大到小的顺序为m3 > m2> m1;故答案为:m3 > m2> m1。
,理解为n(CO2)不变,n(H2)增大,平衡正向移动,CO2的平衡转化率增大,因此投料比m1、m2、m3由大到小的顺序为m3 > m2> m1;故答案为:m3 > m2> m1。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 铝粉投入NaOH溶液中:2Al+2OH-===2AlO2-+H2↑
B. Na与CuSO4溶液反应:Cu2++2Na===2Na++Cu
C. 向AlCl3溶液中加入足量的氨水:Al3++3OH-===Al(OH)3↓
D. Ba(OH)2溶液与稀硫酸反应:Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究NH4Cl与CuO的反应,进行如下实验(部分装置略):
实验 | Ⅰ | Ⅱ |
装置 |
|
|
现象 | 加热试管,产生白烟,试管口有白色固体;试管中有水生成,继续加热,黑色固体变蓝,最终部分变为黄色 | 将细玻璃管口加热至红热,迅速垂直插入 NH4Cl晶体中,一段时间后,取出玻璃管,管口处有亮红色固体 |
经检测,实验Ⅰ中的黄色固体含有CuCl和CuCl2,实验Ⅱ中的亮红色固体为Cu。
(1)实验Ⅰ中试管口的白色固体是______。
(2)实验Ⅰ中黑色固体变蓝,最终部分固体变为黄色的过程中,发生了如下变化:
![]()
①(NH4)2CuCl4固体受热分解的化学方程式是______。
②对于物质X,做出如下假设:
ⅰ.X是NH4Cl。
反应方程式为:________________________________(补充完整)
ⅱ.X是______,理由是______。
(3)实验Ⅰ和实验Ⅱ的现象不同,可能的原因是______(列出2点)。
(4)NH4Cl溶液与CuO反应。
实验Ⅲ 向CuO粉末中加入0.1 mol·L1 NH4Cl溶液,浸泡一段时间后,固体部分溶解,表面无颜色变化,溶液变为蓝色。
资料:ⅰ.相关微粒在水溶液中的颜色:Cu2+蓝色,Cu(NH3)2+和Cu(NH3)42+深蓝色
ⅱ.Cu(NH3)2+![]() Cu2++NH3 Cu(NH3)42+
Cu2++NH3 Cu(NH3)42+![]() Cu2++4NH3
Cu2++4NH3
①设计实验证明实验Ⅲ得到的蓝色溶液中存在Cu(NH3)2+或Cu(NH3)42+。
实验方案是______。
②实验Ⅲ中未观察到NH4Cl溶液与CuO发生氧化还原反应的产物,可能的原因是______(列出1点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】作为高中生,学会利用我们课堂上学到的知识来解决生活中的一些问题,是我们学习的重要目的之一.成外某化学实验兴趣小组,一行四人,利用实验室老师提供的基本仪器和药品,自行购置了鸡蛋,食醋等生活用品,进行了如下探究.
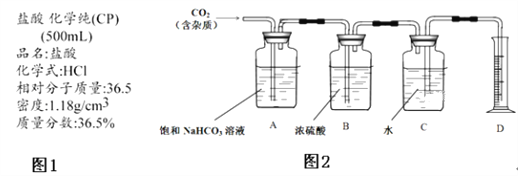
I.甲同学老家在阆中,对儿时在家乡品尝到的阆中老陈醋的滋味记忆犹新,跟随父母来到成都后,总是觉得超市买到的醋不如儿时的味道,查阅相关资料后,得知如图1信息:
①醋分两种,酿造醋和配制醋.正宗的老陈醋必须经长久时间酿造才得此美味,市场上多充斥着工业醋酸加水勾兑的配制醋.
②酿造醋国家标准为醋酸含量必须大于3.50g/100mL,而配制醋国家标准仅为1.50g~3.50g/100mL.
③在老师的帮助下,测定了超市购买的食醋中,醋酸的物质的量浓度为0.75mol/L.
(1)请帮助甲同学计算从超市购买的食醋中醋酸含量为_____g/100mL,属于_____醋(填“酿造”或“配制”).(提示:醋酸摩尔质量为60g/mol)
(2)请写出醋酸与鸡蛋壳(主要成分为CaCO3)反应的离子方程式_____。
II.如图1是成外化学实验室浓盐酸试剂标签上的部分内容.乙同学现用该浓盐酸配制100mL 1molL﹣1的稀盐酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒.请回答下列问题:
(1)配制稀盐酸时,还缺少的仪器有_____;
(2)经计算,配制100mL1molL﹣1的稀盐酸需要用量筒量取上述浓盐酸的体积为_____mL(保留小数点后一位);
(3)对所配制的稀盐酸进行测定,发现其浓度小于1molL﹣1,引起误差的原因可能是_____。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
III.丙同学对课堂上学到的胶体的相关知识产生了浓厚兴趣.
(1)他利用买来的鸡蛋的蛋清配制成溶液,用激光笔照射溶液,发现一条光束穿过鸡蛋清溶液,此现象称为_____。
(2)他将乙同学配制好的盐酸溶液加入到鸡蛋清溶液中,发现出现絮状沉淀,此现象称为_____。
IV.丁同学试图测定CO2的相对分子质量.
①利用丙同学用完后剩下的鸡蛋壳和乙同学配制好的稀盐酸溶液制备CO2;
②查询相关书籍后,设计了如图2所示装置:
(1)其他同学认为B装置在此处没必要,请简述原因_____。
(2)A装置中的饱和NaHCO3溶液可以吸收_____。
(3)实验前测得C装置(含水)重量为50.00g,实验完毕后C装置(含水)重量为40.02g,D中量筒读数为10.0mL,已知H2密度为0.09g/L(以上数据均已折合为标况下数值),请根据以上数据,计算CO2的相对分子质量为_____(保留小数点后一位).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是( )

A. 图甲表示1 mL pH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,说明该酸是强酸
B. 图乙表示恒容密闭容器中其他条件相同时改变温度,反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ
CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ
C. 图丙表示不同温度下水溶液中-lg c(H+)、-lg c(OH-)变化曲线,说明T1>T2
D. 图丁表示1 mol H2和0.5 mol O2反应生成1 mol H2O过程中的能量变化曲线,说明H2的燃烧热是241.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠是一种淡黄色固体,能与水反应,常用在呼吸面具和潜水艇里作为氧气的来源,还可用作熔矿剂,使某些不溶于酸的矿物分解。用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
请回答:(1)由实验现象所得出的有关过氧化钠与水反应的结论是:
a.有氧气生成;b.__________。
(2)某研究性学习小组拟用如图所示装置进行实验,以证明上述结论。
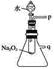
①用以验证结论a的实验方法是:__________;
②用以验证结论b的实验方法是:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用![]() 和
和![]() 为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
已知![]() 和三氯氧磷的性质如下表:
和三氯氧磷的性质如下表:
熔点 | 沸点 | 其他物理或化学性质 | |
|
|
|
|
|
|
|
(1)仪器乙的名称是__________。
(2)实验过程中仪器丁的进水口为__________(选填“![]() ”或“
”或“![]() ”)口。
”)口。
(3)装置B的作用是__________(填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压
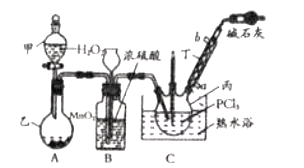
(4)整个装置必须干燥,若未干燥,写出所有副反应的化学方程式______________________________。
(5)制备三氯氧磷所用PCl3测定纯度的方法如下:迅速称取![]() 产品,水解完全后配成
产品,水解完全后配成![]() 溶液,取出
溶液,取出![]() 入过量的
入过量的![]() 碘溶液,充分反应后再用
碘溶液,充分反应后再用![]() 溶液滴定过量的碘,终点时消耗
溶液滴定过量的碘,终点时消耗![]() 溶液。
溶液。
已知:![]() ;
;![]() ;假设测定过程中没有其他反应。根据上述数据,该产品中
;假设测定过程中没有其他反应。根据上述数据,该产品中![]() (相对分子质量为137.5)的质量分数的计算式为__________%。(用含
(相对分子质量为137.5)的质量分数的计算式为__________%。(用含![]() 的代数式表示)
的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:H2(g) + I2(g)![]() 2HI(g) ΔH<0,现有三个相同的1 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol H2和1 mol I2(g),在Ⅱ中充入2 molHI(g) ,在Ⅲ中充入2 mol H2和2 mol I2(g),700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
2HI(g) ΔH<0,现有三个相同的1 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol H2和1 mol I2(g),在Ⅱ中充入2 molHI(g) ,在Ⅲ中充入2 mol H2和2 mol I2(g),700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A. 容器Ⅰ、Ⅱ中正反应速率相同
B. 容器Ⅰ、Ⅲ中反应的平衡常数相同
C. 容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色深
D. 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com