
| A. | 陶瓷、水晶、水泥、玻璃都属于硅酸盐 | |
| B. | SiO2是非金属氧化物,它不与任何酸反应 | |
| C. | 可以用焦炭还原二氧化硅生产硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ | |
| D. | 高纯硅可用于制造光导纤维,高纯二氧化硅可用于制造太阳能电池 |
分析 A、水晶的主要成分为二氧化硅;
B、二氧化硅与氢氟酸反应,生成四氟化硅;
C、焦炭和二氧化硅在高温的条件下生产硅和一氧化碳;
D、二氧化硅是光导纤维的成份,而硅是用于制造太阳能电池;
解答 解:A、水晶的主要成分为二氧化硅,而不是硅酸盐,故A错误;
B、二氧化硅与氢氟酸反应,生成四氟化硅,而不是不与任何酸反应,故B错误;
C、焦炭和二氧化硅在高温的条件下生产硅和一氧化碳,反应的化学方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故C正确;
D、二氧化硅是光导纤维的成份,而硅是用于制造太阳能电池,故D错误;
故选C.
点评 本题考查了硅及其化合物用途,熟悉相关物质的性质是解题关键,注意对硅与二氧化硅用途的区别,为高考频考点.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
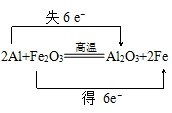 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
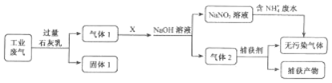
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
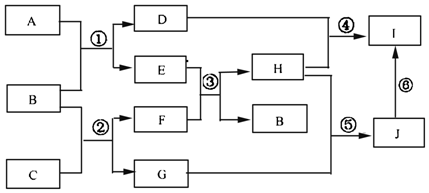
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米铁粉可以高效地去除被污染水体中的 Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附 | |
| B. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| C. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| D. | 火力发电中,燃烧是使化学能转换为电能的关键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com