
| A、①② | B、③④ |
| C、①②③④ | D、①②③ |


科目:高中化学 来源: 题型:
| A、c(OH-)>c(H+) |
| B、c(HCO3-)>c(NH4+) |
| C、c(NH4+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| D、c(H2CO3)+c(H+)=c(CO32-)+2c(NH3?H2O)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A、元素X和Q形成的化合物中不可能含有共价键 |
| B、Q2-比R3-更容易失去电子 |
| C、X、Z、R的最高价氧化物的水化物之间可两两相互反应 |
| D、M(OH)2的碱性比XOH的碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应中Fe3+是氧化剂 |
| B、该反应中Cu被氧化了 |
| C、2mol Fe3+反应后共得到4NA个电子 |
| D、氧化产物与还原产物的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯环是单、双键交替组成的平面环状结构 | |||
| B、苯和乙烯均能使酸性KMnO4溶液褪色 | |||
C、苯的硝化反应:
 属于取代反应 属于取代反应 | |||
| D、苯跟溴水在催化剂作用下发生取代反应生成溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
13 6 |
12 6 |
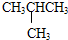
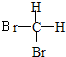 和
和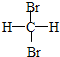 E.CH4和CH3(CH2)2CH3
E.CH4和CH3(CH2)2CH3查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com