
【题目】类比法是常见的研究物质性质的方法之一,可用来预测很多物质的性质,但类比是相对的,必须遵循客观实际,下列说法中正确的是( )
A. ![]() 通入
通入![]() 溶液中没有现象,
溶液中没有现象,![]() 通入
通入![]() 溶液中也无明显现象
溶液中也无明显现象
B. ![]() 与
与![]() 会因为水解相互促进而完全反应生成
会因为水解相互促进而完全反应生成![]() 和
和![]() ,
,![]() 与
与![]() 也可以水解相互促进至完全反应生成
也可以水解相互促进至完全反应生成![]() 和
和![]()
C. 偏铝酸是一元酸,因此,![]() 也是一元酸
也是一元酸
D. ![]() 在标准状况下为气体,所以
在标准状况下为气体,所以![]() 在标准状况下同样为气体
在标准状况下同样为气体
科目:高中化学 来源: 题型:
【题目】在一定温度和体积固定的密闭容器中,可逆反应H2(g)+I2(g) ![]() 2HI(g) (无色)达平衡状态,该状态下,说法不正确的是( )
2HI(g) (无色)达平衡状态,该状态下,说法不正确的是( )
A. 可逆反应停止 B. I2浓度不再变化
C. HI浓度不再变化 D. 混合气体颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Cu(IO3)2+24KI+12H2SO4=2CuI![]() (碘化亚铜)+13I2+12K2SO4+12H2O,下列说法正确的是 ( )
(碘化亚铜)+13I2+12K2SO4+12H2O,下列说法正确的是 ( )
A.Cu(IO3)2作氧化剂,Cu(IO3)2中只有碘元素被还原
B.CuI既是氧化产物又是还原产物
C.每生成1mol CuI,有11mol KI发生氧化反应
D.每转移1.1mol电子,有0.2mol IO3-被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
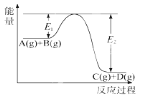
(1)该反应是________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”、“减小”或“不变”),原因是________。
(3)反应体系中加入催化剂对反应热是否有影响_______(填“有”、“无”)。
(4)在反应体系中加入催化剂,反应速率增大,此时E1______,E2_______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理含氰![]() 废水可以用以下两种方法:
废水可以用以下两种方法:
Ⅰ:![]() (未配平),其中A为参与大气循环的气体
(未配平),其中A为参与大气循环的气体
Ⅱ:①![]() (未配平)
(未配平)
②![]() 下列说法正确的是( )
下列说法正确的是( )
A. ![]() 和
和![]() 的电子式分别为
的电子式分别为![]()
![]()
B. 方法Ⅰ中,每生成![]() ,转移
,转移![]() 个电子
个电子
C. 方法Ⅱ中,![]() 是反应②的氧化产物
是反应②的氧化产物
D. 方法Ⅱ的反应①中,![]() 与
与![]() 的物质的量之比为1∶1
的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q、M是六种原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z的单质是空气的主要成分之一,R、Q、M三种元素的最高价氧化物对应的水化物相互之间均可反应,M的单质是黄绿色气体。请回答下列问题:
(1)Z和M的非金属性强弱Z_________M(填“<”“>”或“=”)。
(2)Z、Q、M简单离子半径由大到小的顺序为__________________(用离子符号表示)。
(3)X和Z两元素形成的原子个数比为1∶1的化合物电子式为___________。
(4)Y元素的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式为______________,所生成的物质水溶液中离子浓度由大到小的顺序为_______________。
(5)![]() 是一种高效安全的杀菌消毒剂,它能将电镀废水中的
是一种高效安全的杀菌消毒剂,它能将电镀废水中的![]() 氧化为两种无毒的气体,自身还原成最低价的简单离子,写出该反应的离子方程式___________________________。
氧化为两种无毒的气体,自身还原成最低价的简单离子,写出该反应的离子方程式___________________________。
(6)用电解法可制备![]() ,电解总反应为
,电解总反应为![]() 。已知阳极产物为
。已知阳极产物为![]() ,该物质在水中水解生成
,该物质在水中水解生成![]() 和
和![]() ,则该电极生成
,则该电极生成![]() 的电极反应为________________。
的电极反应为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 28g乙烯所含共用电子对数目为2NA
B. 14g乙烯、丙烯、丁烯的混合气体中,所含原子数为3NA
C. 标准状况下,11.2L氟化氢所含分子数为0.5NA
D. 1.5g甲基所含电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(分子式为 H2C2O4,沸点:150℃)是生物体的一种代谢产物,广泛分布于植物、动 物和真菌体中。下列有关判断不正确的是
A.草酸的摩尔质量是 90 g/mol
B.草酸中碳元素的质量分数为 13.3%
C.1 mol 草酸中约含有 6.02×1023 个分子
D.1 mol 草酸在标准状况下的体积约为 22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75% ,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为无色液体。反应生成的水均已略去。它们有如下图所示的关系。

(1)写出化学式:A___________B____________J_____________。
(2)反应③中每生成1molF,转移电子的数目为:___________。
(3)反应④的化学方程式为:________________________________________________。
(4)离子方程式分别为:反应②__________________________________________;
⑤__________________________________________________________。
(5)反应①中,每1.00gC与足量的F作用,恢复到25℃放出55.6kJ热量,写出反应①的热化学方程式__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com