
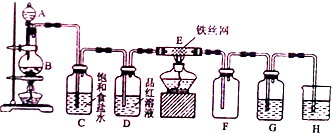
分析 ①仪器A的名称是分液漏斗;B中的物质与浓盐酸发生氧化还原反应生成氯气,浓盐酸具有还原性,所以B中的物质具有氧化性;二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,注意浓盐酸在离子方程式中应该写成离子形式;
②防止生成的氯化铁接触到水,所以装置G中的试剂为浓硫酸;氯水具有漂白性,所以装置D中的现象为品红溶液褪色,装置H是氢氧化钠溶液,其作用是吸收多余的氯气;
③装置E中发生铁与氯气反应生成氯化铁,反应的化学方程式为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,左边应加干燥的装置.
解答 解:①仪器A的名称是分液漏斗;B中的物质与浓盐酸发生氧化还原反应生成氯气,浓盐酸具有还原性,所以B中的物质具有氧化性;二氧化锰与浓盐酸在加热条件下反应生成氯气,反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:分液漏斗;氧化性;MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②防止生成的氯化铁接触到水,所以装置G中的试剂为浓硫酸;氯水具有漂白性,所以装置D中的现象为品红溶液褪色,装置H是氢氧化钠溶液,其作用是吸收多余的氯气,
故答案为:浓硫酸;品红溶液褪色;吸收多余的氯气;
③装置E中发生铁与氯气反应生成氯化铁,反应的化学方程式为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,在装置D和E之间添加一个干燥的装置,
故答案为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;在装置D和E之间添加一个干燥的装置.
点评 本题考查学生对性质实验方案设计题的掌握,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有离子键的化合物中一定没有共价键 | |
| B. | 有共价键的化合物中一定没有离子键 | |
| C. | 物质的熔化过程可能既破坏离子键又破坏共价键 | |
| D. | 物质的熔化过程可能不破坏任何化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与乙醇反应不如与水反应活泼,体现了羟基对乙基的影响 | |
| B. | 在溴乙烷分子中,溴原子与乙基之间的影响是相互的 | |
| C. | 苯酚比苯更容易发生苯环上的取代反应,体现了羟基对苯基的影响 | |
| D. | 苯酚与溴水作用可得三溴苯酚,而苯与纯溴作用,要在催化剂作用下才只得到一溴代物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com