
| 装置 | 烧杯中的液体 | 现象(5分钟后) |
 | ①2mL1mol/LKl溶液+5滴淀粉 | 无明显变化 |
| ②2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L HCl | 溶液变蓝 | |
| ③2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L KCl | 无明显变化 | |
| ④2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
| 烧杯中的液体 | 现象(5小时后) |
| ⑤2mLpH=8.5混有KOH的1mol/L KI溶液+5滴淀粉 | 溶液才略变蓝 |
| ⑥2mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 | 无明显变化 |
分析 (1)②溶液变蓝,说明生成碘单质;
(2)对照实验,氯离子有无影响,单质的生成;
(3)盐酸是强电解,而醋酸是弱电解质,同浓度的两种酸氢离子浓度不同,导致颜色较②浅;
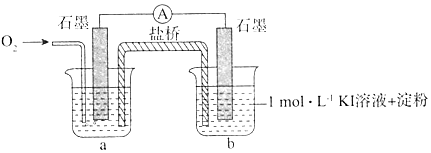
(4)I.i.pH=10时O2不能氧化I-,所以烧杯a中的溶液为pH=10的KOH溶液;
ii.如果能构成原电池,说明pH=10时O2能氧化I-;
Ⅱ.碘单质在碱性条件下发生歧化反应生成IO3-和碘离子,由此书写反应的方程式;
(5)推测实验①中性条件下,O2的氧化性比较弱;碱性条件下碘离子被氧化生成碘单质,后碘单质又迅速在碱性条件下发生歧化反应生成碘酸根离子和碘离子.
解答 解:(1)溶液变蓝,说明生成碘单质,反应的离子的方程式为:4I-+O2+4H+=2I2+2H2O,故答案为:4I-+O2+4H+=2I2+2H2O;
(2)对照实验,氯离子有无影响,单质的生成,故答案为:验证Cl-是否影响KI与O2的反应;
(3)盐酸是强电解,而醋酸是弱电解质,同浓度的两种酸氢离子浓度不同,所以其他条件相同时,CH3COOH是弱电解质,溶液中c(H+)较盐酸小,O2的氧化性减弱,故答案为:其他条件相同时,CH3COOH是弱电解质,溶液中c(H+)较盐酸小,O2的氧化性减弱;
(4)I.ⅰ.pH=10时O2不能氧化I-,所以烧杯a中的溶液为pH=10的KOH溶液,故答案为:pH=10的KOH溶液;
ⅱ.如果能构成原电池,说明pH=10时O2能氧化I-,所以电流表指针偏转,烧杯b的溶液颜色变深,说明pH=10时O2能氧化I-,故答案为:电流表指针偏转,烧杯b的溶液颜色变深;
Ⅱ.碘单质在碱性条件下发生歧化反应生成IO3-和碘离子,由此书写反应的方程式为:3I2+6OH-=IO3-+5I-+3H2O,故答案为:3I2+6OH-=IO3-+5I-+3H2O;
(5)推测实验①中性条件下,O2的氧化性比较弱;碱性条件下碘离子被氧化生成碘单质,后碘单质又迅速在碱性条件下发生歧化反应生成碘酸根离子和碘离子,故答案为:中性条件下,O2的氧化性比较弱,该反应速率慢,短时间内难以生成“一定量”碘单质使溶液颜色发生变化;pH=10的KOH溶液中I-被氧化生成I2,I2迅速发生歧化反应变为IO3-和I-.
点评 本题考查实验的设计与探究,难度中等.有利于培养学生分析和解决问题的能力.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:填空题
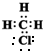 ,
,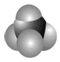 是甲烷的比例模型
是甲烷的比例模型 、
、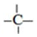 四种基团,若要使烷烃碳个数最少,写出符号条件所有烷烃的结构简式CH3CH2CH(CH3)C(CH3)3、CH3CH(CH3)C(CH3)2CH2CH3、CH3C(CH3)2CH2CH(CH3)2
四种基团,若要使烷烃碳个数最少,写出符号条件所有烷烃的结构简式CH3CH2CH(CH3)C(CH3)3、CH3CH(CH3)C(CH3)2CH2CH3、CH3C(CH3)2CH2CH(CH3)2查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 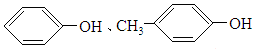 | B. | 甲苯和甘油(丙三醇) | ||
| C. | CH4、C2H4O2 | D. | C3H4、C3H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第6周期,第ⅣA族 | B. | 第7周期,第ⅥA族 | C. | 第7周期,第ⅣA族 | D. | 第8周期,第ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1 molNH3通入水中得到1L溶液,则NH4+与NH3•H2O粒子总数为NA | |
| B. | 1.2 g NaHSO4晶体中含有离子总数为0.03 NA | |
| C. | 标准状况下,2.24 L SO3含有的分子数为0.1 NA | |
| D. | 14 g乙烯和环丙烷(C3H6)混合气体中的碳原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油主要含碳、氢元素,是烷烃、环烷烃、芳香烃的混合物 | |
| B. | 石油中含有C5~C11的烷烃,可以通过石油的常压分馏得到汽油 | |
| C. | 含C20以上烷烃的重油经减压分馏可以得到煤油和柴油 | |
| D. | 石油经分馏得到的各馏分仍是多种烃的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氢气是一种清洁对可再生能源.某氢燃料电池轿车,每行驶100km仅耗氢气1kg左右,同时消耗氧气约是( )
氢气是一种清洁对可再生能源.某氢燃料电池轿车,每行驶100km仅耗氢气1kg左右,同时消耗氧气约是( )| A. | 100mol | B. | 250mol | C. | 500mol | D. | 1000 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com