
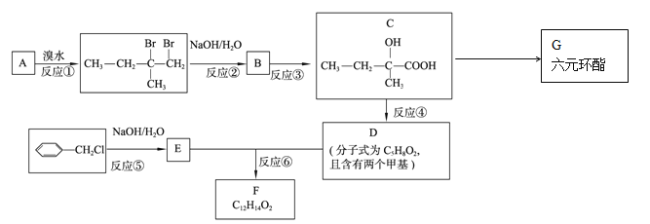
【题目】(有机化学基础)分子式为C12H14O2的有机物F广泛用于制备香精的调香剂。为了合成该有机物,某实验室的科技人员设计了下列合成路线。
 试回答下列问题:
试回答下列问题:
(1)A物质名称为(系统命名) 。
(2)合成路线中反应③所属反应类型为 。
(3)有机物G的结构简式为 。
(4)有机物D中所含官能团的名称为 。
(5)关于有机物C,下列说法正确的是( )
A.等物质的量的C分别与足量的金属钠和NaHCO3反应,后者产生气体多
B.一定条件下,有机物C能通过缩聚反应形成高分子化合物
C.1molC完全燃烧生成CO2和H2O,消耗的氧气的物质的量为6mol
D.有机物C中的所有碳原子可能在同一平面上
(6)反应⑥的化学反应方程式为 。
(7)F有多种同分异构体,请写出符合下列条件的所有同分异构体的结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为-CH2COOCH3; 。
【答案】(1)2-甲基-1-丁烯;(2)氧化反应
(3) (4)碳碳双键和羧基;(5)AB
(4)碳碳双键和羧基;(5)AB
(6)![]() ;(7)3种。
;(7)3种。
【解析】
试题分析:(1)A和溴水发生加成反应,去掉两个溴原子,且这两个碳原子再形成一个共价键,结构简式: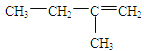 ,其名称为2-甲基-1-丁烯;
,其名称为2-甲基-1-丁烯;
(2)反应②是卤代烃在氢氧化钠溶液中发生水解反应,羟基取代了溴原子的位置,则B的结构简式为 ,B发生氧化,根据C的分子式可知-CH2OH被氧化成-COOH,另一个羟基连接碳上无氢不能被氧化,则C 的结构简式为
,B发生氧化,根据C的分子式可知-CH2OH被氧化成-COOH,另一个羟基连接碳上无氢不能被氧化,则C 的结构简式为 ,对比C、D的分子式,D比C缺少一个H2O,说明C发生消去反应,则D的结构简式为
,对比C、D的分子式,D比C缺少一个H2O,说明C发生消去反应,则D的结构简式为![]() ,根据反应⑤的条件,可知发生的水解反应,羟基取代了氯原子的位置,推出E的结构简式:
,根据反应⑤的条件,可知发生的水解反应,羟基取代了氯原子的位置,推出E的结构简式:![]() ,E、D发生酯化反应生成F,则F的结构简式为
,E、D发生酯化反应生成F,则F的结构简式为![]() 。根据以上分析可知合成路线中反应③所属反应类型为氧化反应。
。根据以上分析可知合成路线中反应③所属反应类型为氧化反应。
(3)G为六元环酯,说明C发生分子内酯化反应生成G,则G的结构简式为 。
。
(4)根据以上分析可知有机物D中所含官能团的名称为碳碳双键和羧基。
(5)A.C分子中含有羟基和羧基,羟基与碳酸氢钠不反应,则等物质的量的C分别与足量的金属钠和NaHCO3反应,产生的气体一样多,A正确;B. C分子中含有羟基和羧基,一定条件下,有机物C能通过缩聚反应形成高分子化合物,B正确;C.1molC完全燃烧生成CO2和H2O,消耗的氧气的物质的量为5mol,C错误;D.有机物C分子中含有4个饱和碳原子,则其中的所有碳原子不可能在同一平面上,D错误,答案选AB。
(6)反应⑥的化学反应方程式为
![]() 。
。
(7)①属于芳香族化合物,推知含有苯环,含有F相同的官能团,推知应含有碳碳双键和酯的结构;②苯环上有两个取代基,且苯环上一氯代物只有两种,推知两个取代基位置是对位;则符合条件的F的同分异构体: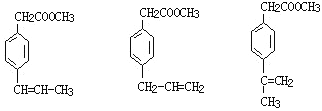 ,有3种。
,有3种。


科目:高中化学 来源: 题型:
【题目】(1)分析如图所示的三个装置,回答下列问题:

①装置a中铝电极上的电极反应式为________________________。
②装置b中产生气泡的电极为________电极(填“铁”或“铜”),装置c中铜电极上的电极反应式为_____________________________________。
燃料电池是一种高效低污染的新型电池。燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲烷、肼等。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为:__________________。
②电池工作一段时间后电解质溶液的pH________(填“增大”“减小”或“不变”)。
(3)肼分子(H2N—NH2)可以在氧气中燃烧生成氮气和水,利用肼、氧气与KOH溶液组成碱性燃料电池,请写出该电池反应的负极电极反应式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
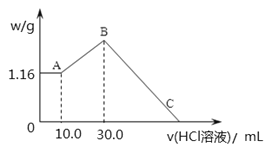
①A点的沉淀物的化学式为 。
②写出A点至B点发生反应的离子方程式: 。
③原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的
体积为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质的转化关系如图所示,其中甲、乙为单质,丙、丁为化合物。

①若工业上用该反应制粗硅写出该反应的化学方程式: 。
②若该反应可用于焊接铁轨且丙为红棕色固体则该反应的化学方程式为: 。
③若丁为具有磁性的黑色晶体写出该反应的化学方程式: 。
④若甲为黄绿色气体,且该反应用来检验工业上甲是否泄漏,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年5月郴州成功举办了第三届中国(湖南)国际矿物宝石博览会。矿博会上展示了色彩缤纷、形状各异的金属矿物,下列金属的冶炼属于热还原法的是
A.2NaCl(熔融)= 2Na+Cl2↑
B.WO3+3H2 ![]() W+3H2O
W+3H2O
C.Fe+CuSO4 = Cu+FeSO4
D.2Ag2O ![]() 4Ag+O2↑
4Ag+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
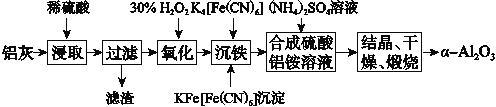
(1)铝灰中氧化铝与硫酸反应的化学方程式为__________________________。
(2)图中“滤渣”的主要成分为________(填化学式)。
(3)加30% H2O2溶液发生反应的离子方程式为_________________________。
(4)煅烧硫酸铝铵晶体,发生的主要反应为
4[NH4Al(SO4)2·12H2O]2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过如图所示的装置。

①集气瓶中收集到的气体是________(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有________(填化学式)。
③KMnO4溶液褪色(MnO被还原为Mn2+),发生反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]四川含有丰富的矿产资源,钒矿、钛矿、黄铁矿等七种矿产储量位居全国第1位。回答下列问题:
(1)V2O5常用作SO2 转化为SO3的催化剂。SO2 分子中键角 120°(填“>”、“<”或“=”);SO3分子中S原子的杂化轨道类型为 ;V2O5 溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 。
(2)VO2+在酸性条件下可被草酸(H2C2O4)还原为VO2+,草酸被氧化为CO2,该反应用于钒含量的测定。写出反应的离子方程式 。
(3)钛在元素周期表中的位置为 ,其电子排布式为 。用乙醚从TiCl3的饱和溶液中萃取可得TiCl3·6H2O绿色晶体,其配位数为6,将1mol该晶体加入到足量硝酸银溶液中可得2mol白色沉淀,则该配合物的化学式是 。
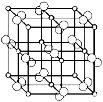
(4)科学家通过X射线探明,黄铁矿(FeS2)的晶体结构与NaCl的晶体结构相似,若在FeS2晶体中阴阳离子间最近距离为a cm,阿伏伽德罗常数为NA。则晶体密度表达式为 g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com