
下列有关化学用语的表示正确的是()
A.N2的电子式: 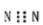 B. 甲烷分子的比例模型是
B. 甲烷分子的比例模型是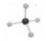
C. 硝基和二氧化氮两种粒子所含电子数相等 D. 甲基的电子式: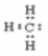
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
取xg铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960mL的NO2气体和672mLN2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02g。则x等于
A.8.64g B.9.00g C.9.20g D.9.44g
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三上学期期中考试理科综合化学试卷(解析版) 题型:选择题
A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、NaHSO4溶液和BaCl2溶液中的一种,已知A、B溶液的pH相同,A、C溶液混合后溶液变浑浊。下列说法正确的是
A.D溶液的pH<7
B.C溶液中的溶质溶于水促进了水的电离
C.溶液A滴入到碳酸氢钠溶液中产生气体
D.溶液B进行焰色反应呈黄色
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列叙述正确的是()
A.1mol Na被完全氧化生成Na2O2,失去NA个电子
B.1.0 L 0.1mol/L的NaAlO2溶液中含有的氧原子数为0.2NA
C.25℃pH=13的NaOH溶液中含有OH-的数目为0.1NA
D.1molCl2与足量的铁反应,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
下列关于氧化性、还原性的判断正确的是()
A.B的阳离子的氧化性比A的阳离子强,说明A元素的金属性一定比B元素强
B.发生氧化还原反应时,A原子失去的电子比B原子多,证明A的金属性一定比B强
C.适量的Cl2通入FeI2溶液中可发生反应:3Cl2+6FeI2=2FeCl3+4FeI3
D.一定量氯气通入30mL10.00mol·L-1的氢氧化钠溶液中,加热后形成NaCl、NaClO、NaClO3共存的溶液,若反应中转移的电子为n mol,则0.15<n<0.25
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数,下列叙述正确的是()
A.标准状况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA
B.0.1molNa2O2晶体中含有0.3NA个离子
C.pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
D.标准状况下,22.4L甲醇中含有的氧原子数为1.0NA
查看答案和解析>>
科目:高中化学 来源:2015届四川省2015届高三9月理综化学试卷(解析版) 题型:选择题
在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NH+4、I-、NO3-
C.FeCl2溶液:K+、Na+、SO42-、AlO2-
D.  =0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
查看答案和解析>>
科目:高中化学 来源:2015届四川省资阳市高三一诊理综化学试卷(解析版) 题型:填空题
(13分)有机物F是有机合成工业中一种重要的中间体。以甲苯和丙烯为起始原料合成F的工艺流程如下:
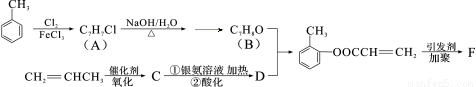
回答下列问题:
(1)化合物B中的含氧官能团名称是 。F的结构简式为 。
(2)写出C与银氨溶液共热的化学反应方程式: 。
(3)化合物D不能发生的反应有 (填序号)。
①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤水解反应
(4)B的含苯环结构的同分异构体还有 种,其中一种的核磁共振氢谱中出现4个峰且不与FeCl3溶液发生显色反应的是 (填结构简式)。
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三(补习班)10月月考理综化学试卷(解析版) 题型:实验题
(17分)绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:
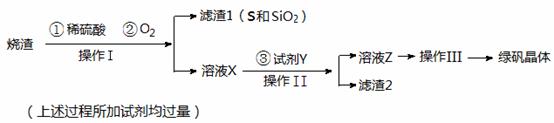
试回答:
(1)操作I为 (填写操作名称)。
(2)操作III的顺序依次为: 、冷却结晶、过滤 、 、干燥。
(3)试剂Y(一种单质)与溶液X反应的离子方程式为 。
(4)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需
②该同学设计的下列滴定方式,最合理的是 (夹持部分略去)(填字母序号)
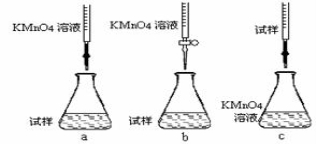
③滴定时发生反应的离子方程为:
④若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果 (填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com