
| A. | 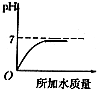 | B. | 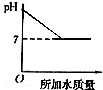 | C. | 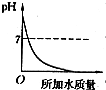 | D. | 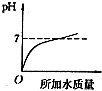 |
分析 酸无论如何稀释不能变成碱液,碱无论如何稀释不能变成酸溶液,当无限稀释时要考虑水的电离,所以导致酸溶液无论如何稀释不能变成碱溶液,碱无论如何稀释不能变成酸溶液,据此解题.
解答 解:A.原溶液呈酸性,其pH为0,加水稀释酸性减弱,pH增大,但不会大于等于7,故A正确;
B.原溶液呈碱性,其pH大于7,加水稀释碱性减弱,pH减小,但不会等于7,故B错误;
C.原溶液呈碱性,其pH大于7,加水稀释碱性减弱,pH减小,但不会小于7,故C错误;
D.原溶液呈酸性,其pH为0,加水稀释酸性减弱,pH增大,但不会大于7,故D错误.
故选A.
点评 本题考查了溶液的稀释与溶液PH值的关系,要注意:酸无论如何稀释不能变成碱液,碱无论如何稀释不能变成酸溶液,题目难度不大.


科目:高中化学 来源: 题型:选择题
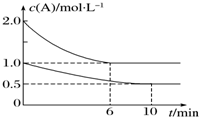 在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )
在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )| A. | 甲和乙中A的平衡转化率相等 | |
| B. | 给甲容器加压可缩短反应达到平衡的时间 | |
| C. | 给乙容器升温可缩短反应达到平衡的时间 | |
| D. | 甲容器中A的反应速率为0.1 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
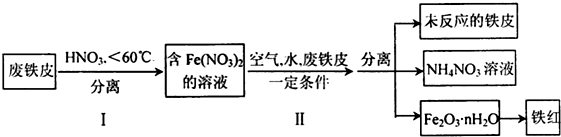
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有$\frac{1}{2}$NA个硫原子被还原 | B. | 有$\frac{1}{3}$NA个氮原子被氧化 | ||
| C. | 有$\frac{3}{4}$NA个二氧化硫分子生成 | D. | 有$\frac{2}{3}$NA个硫酸铵分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 一定条件下6.4gS02与足量氧气反应生成S03,转移电子数小于0.2NA | |
| C. | lmol羟基(一OH)与17gNH3所含电子数都为NA | |
| D. | 适量铜粉溶解于1 L0.5mol/L稀硝酸中,当生成2.24LNO时,溶液中氮原子数0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入醋酸溶液CH3COOH+NH3═CH3COONH4 | |
| B. | 澄清的石灰水跟盐酸反应H++OH-═H2O | |
| C. | 碳酸钡溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 金属钠跟水反应Na+H2O═Na ++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
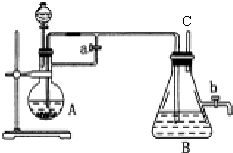
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁钉在空气中出现红色的铁锈,其负极反应式为:Fe-3e-═Fe3+ | |
| B. | 氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+NH4+═Mg2++NH3•H2O | |
| C. | 向足量铝粉与氢氧化钠溶液反应后的溶液中滴加碳酸氢钠溶液:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- | |
| D. | 漂白粉溶液中加氯化亚铁溶液产生大量沉淀:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com