
在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:
Ca(OH)2(s)  Ca2+(aq) + 20H-(aq),当向此悬浊液中加入少量氧化钙固体时,下列说法正确的是
Ca2+(aq) + 20H-(aq),当向此悬浊液中加入少量氧化钙固体时,下列说法正确的是
A.c(Ca2+)增大 B.c(Ca2+)不变
C.c(OH-)增大 D.Ca(OH)2固体的质量不变
科目:高中化学 来源: 题型:
平衡是化学反应原理中的重要内容。按要求回答下列问题:
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1 平衡常数为K1
2SO3(g) ΔH1 平衡常数为K1
2NO(g)+O2(g) 2NO2(g) ΔH2 平衡常数为K2
2NO2(g) ΔH2 平衡常数为K2
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的
SO3(g)+NO(g)的
 ΔH=______ (用ΔH 1和ΔH 2表示);此反应该温
ΔH=______ (用ΔH 1和ΔH 2表示);此反应该温
度下的平衡常数K=______(用K1和K2表示)。
(2)已知A(g)+B(g)  C(g)+D(g),该反应在
C(g)+D(g),该反应在
3L密闭容器中,在两种不同的条件下进行反应,
A、B的起始物质的是分别为3.0mol和6.0mol,
其中实验I的条件为T1℃。A的物质的量随时间
的变化如图所示。
①实验Ⅱ可能改变的条件是_______________。
②T1℃时该反应的平衡常数为_____(用分数表
示),达到平衡时,A的反应速率为____。
(3)已知HCN溶液的电离平衡常数Ka=10-5 mol•L-1,c平衡(HCN)≈c起始(HCN),水的电离可不计,则此温度下0.1 mol•L-1的HCN溶液的pH=_________。
(4)对于0.1mol•L-1 Na2CO3溶液,该溶液中离子浓度由大到小的顺序是______,向该溶液中加水稀释的过程中,c(H2CO3)逐渐____(填“增大”“不变”或“减小”, 下同) ,c(H2CO3)/ c(CO32-)逐渐______。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素E的氯化物ECln的熔点为-78℃,沸点为59℃;若0.2molECln与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀。下列判断错误的是
A.E可能是一种金属元素 B.在ECln中E与Cl之间形成共价键
C.E位于元素周期表的IVA族 D.E的一种氧化物为EO
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省淄博市高二12月月考化学试卷(解析版) 题型:选择题
将0.2mol/L HCN溶液和0.1mol/L NaOH溶液等体积混合后溶液呈碱性,下列关系式中不正确的是
A. c(HCN) >c(CN—) B. c(Na+)>c(CN—)
C. c(HCN)-c(CN—)=c(OH—) D. c(HCN)+c(CN—)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省淄博市高二12月月考化学试卷(解析版) 题型:选择题
将下列溶液蒸干、并灼热后,仍能得到原溶质固体的是
A、AlCl3溶液 B、NaAlO2溶液
C、NaHCO3溶液 D、FeSO4溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省东营市高一上学期第三次模块考试化学试卷(解析版) 题型:实验题
(10分)某课外学习小组的同学设计了如图的装置,以验证SO2的氧化性、还原性和漂白性(A中长颈漏斗上固定了多孔塑料板,用于放置块状固体)。回答以下问题:

(1)用Na2SO3粉末和硫酸溶液制取SO2气体,应选用_____(选“A”或“C”)做气体发生装置。在确保气密性良好的情况下,小组同学仍发现产生气体的速率缓慢,可能的原因是 (回答出一种即可)
(2)课外学习小组的同学用FeS块状固体和稀硫酸反应制取H2S气体,反应的方程式为 ;
(3)单独使SO2气体通过E装置时的现象是 ;
使SO2与H2S在B装置中混合,现象是_______________________________。
(4)F装置可用盛有 溶液的洗气瓶代替。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省东营市高一上学期第三次模块考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl-
B.0.1 mol·L-1FeCl3溶液:K+、NH4+、I-、OH-
C.8 mol·L-1HNO3的溶液:Fe2+、H+、Cl-、Na+
D.0.1 mol·L-1的NaOH溶液:K+、Na+、SO42-、CO32-
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省邢台市高二12月月考化学试卷(解析版) 题型:填空题
(7分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
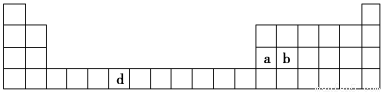
(1)请写出元素d的基态原子电子排布式________________________________________。
(2)b元素的氧化物中b与氧元素之间的共价键类型是________。其中b原子的杂化方式是_______。
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为M,则一个晶胞中a原子的数目为________,该晶体的密度为________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015上海市闵行区高二第一学期期末考试化学试卷(解析版) 题型:填空题
下面是某学生实验的一次数据,请完成计算
坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
11.721g | 22.692g | 18.631g |
X=__________________;(精确到0.01)
实验相对误差是_________________。(保留小数点后一位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com