
将下列物质的量浓度相等的溶液等体积两两混合有白色沉淀生成,加入过量的稀硝酸后,沉淀消失并放出气体,再加入硝酸银溶液又有白色沉淀生成的是
| A.Na2CO3和Ca(OH)2 | B.Na2CO3和CaCl2 |
| C.Ca(HCO3)2和NaOH | D.Na2SO4和Ba(NO3)2 |
B
解析试题分析:A、Na2CO3和Ca(OH)2等浓度等体积混合产生白色沉淀,Ca2++CO32-=CaCO3↓,加入过量硝酸发生反应,OH-+H+=H2O;CaCO3+2H+=CO2↑+H2O+Ca2+;再加入AgNO3溶液无白色沉淀生成,故A不符合; B、Na2CO3和CaCl2再加入AgNO3溶液,Ag++Cl-=AgCl↓,有白色沉淀生成,故B符合;
C、Ca(HCO3)2和NaOH等浓度等体积混合产生白色沉淀,Ca2++HCO3-+OH-=CaCO3↓+H2O,加入过量硝酸发生反应,CaCO3+2H+=CO2↑+H2O+Ca2+,但是加入AgNO3溶液无白色沉淀产生;故C不符合;
D、Na2SO4和Ba(NO3)2等浓度等体积混合产生白色沉淀,Ba2++SO42-=BaSO4↓,加入过量硝酸不发生反应,无沉淀消失和气体生成,故D不符合;
考点:物质的检验鉴别
点评:本题有一个突破点在于稀硝酸体系中出现沉淀,则可以排除A、C选项,再根据有气体生成可以得正确选项。


科目:高中化学 来源: 题型:
| 3 |
| 2 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省台州市路桥中学高一上学期期中考试化学试卷(带解析) 题型:单选题
下列关于碳酸钠和碳酸氢钠的比较中,正确的是
| A.相同温度下,在水中,碳酸氢钠的溶解度大于碳酸钠的溶解度 |
| B.将石灰水加入碳酸氢钠溶液中不产生沉淀,加入碳酸钠溶液中产生白色沉淀 |
| C.将100 mL 0.10 mol/L盐酸溶液分别逐滴滴入到10 mL 1.00 mol/L的碳酸钠溶液或10 mL 1.00 mol/L碳酸氢钠溶液中,两者都能放出二氧化碳气体,但碳酸氢钠与酸反应产生二氧化碳的剧烈程度明显强于碳酸钠 |
| D.在一定温度下,物质的量浓度相同时,碳酸氢钠溶液的碱性弱于碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源:2015届浙江省台州市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列关于碳酸钠和碳酸氢钠的比较中,正确的是
A. 相同温度下,在水中,碳酸氢钠的溶解度大于碳酸钠的溶解度
B. 将石灰水加入碳酸氢钠溶液中不产生沉淀,加入碳酸钠溶液中产生白色沉淀
C. 将100 mL 0.10 mol/L盐酸溶液分别逐滴滴入到10 mL 1.00 mol/L的碳酸钠溶液或10 mL 1.00 mol/L碳酸氢钠溶液中,两者都能放出二氧化碳气体,但碳酸氢钠与酸反应产生二氧化碳的剧烈程度明显强于碳酸钠
D. 在一定温度下,物质的量浓度相同时,碳酸氢钠溶液的碱性弱于碳酸钠溶液
查看答案和解析>>
科目:高中化学 来源:2010年江苏省南京市高三上学期期中考试化学试题 题型:实验题
(8分)有一包NaHCO3和KHCO3的混合物样品。某研究性学习小组对其进行如下探究。实验装置如图所示。将一定质量的混合物样品加入锥形瓶中,用针筒a分次注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒壁之间的摩擦)
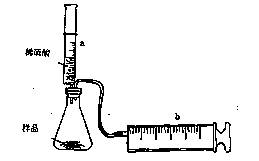 |
(1)为了较准确地测量反应生成的CO2体积,必须保证整个装置的气密性良好。如果往锥形瓶中注入稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2 mL,则反应中生成的CO2气体体积为 mL。
(2)某学生通过实验,测得如下数据(所用稀硫酸的物质的量浓度相矧),下列分析推理错误的是 。
|
|
50mL稀硫酸 |
50mL稀硫酸 |
50mL稀硫酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
①稀硫酸的物质的量浓度为1.5mol/L
②15.7 g混合物恰好与稀硫酸完全反应
③加入混合物9.2 g时稀硫酸未反应完
④计算出样品中NaHC03和KHC03物质的量之比为1:1
(3)某同学设计了另一种方案,其操作流程如下:
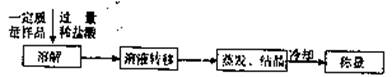
在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHC03和KHC03物质的量之比 (选填“偏人”、“偏小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com