
| A. | Cl2 | B. | CO2 | C. | NH3•H2O | D. | AgCl |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| B. | 氧化反应均为吸热反应 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 断开化学键会放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积④<①<②<③ | B. | 密度①<③<④<② | C. | 质量④<①<③<② | D. | 氢原子数②<④<③<① |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
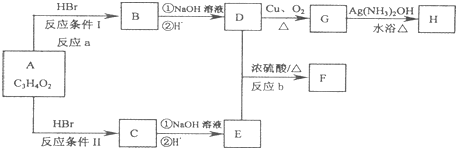
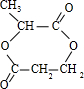 +2H2O
+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在溴水中存在如下平衡:Br2+H2O?HBr+HBrO,当加入NaOH溶液后颜色变浅 | |
| B. | 对2NO2(g)?N2O4(g) 平衡体系,增加压强使颜色变浅 | |
| C. | 反应CO+NO2?CO2+NO△H<0升高温度使平衡向逆方向移动 | |
| D. | 向双氧水溶液中滴入FeCl3 溶液后,产生气泡速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制稀硫酸时将水倒入浓硫酸中并不断搅拌 | |
| B. | 不慎洒出的酒精在桌上着火时,立即用水扑灭 | |
| C. | 大量氯气泄漏时,迅速离开现场并尽量往高处去 | |
| D. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 1:3 | C. | 3:2 | D. | 1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com