
| 催化剂 |
| △ |
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
| △c |
| △t |
| 消耗量 |
| 起始量 |
| 催化剂 |
| △ |
| c2(SO3) |
| c2(SO2×c(O2)) |
| c2(SO3) |
| c2(SO2×c(O2)) |
| ||
| 3min |
| 2mol-1.4mol |
| 2mol |


科目:高中化学 来源: 题型:
| A、Al(OH)3+3HCl═AlCl3+3H2O |
| B、NH4HCO3═NH3↑+H2O+CO2↑ |
| C、H2O+CaO═Ca(OH)2 |
| D、3Cl2+2NH3=N2+6HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
70 30 |
208 82 |
| A、111 | B、112 |
| C、113 | D、114 |
查看答案和解析>>
科目:高中化学 来源: 题型:
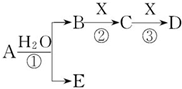 A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):
A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A、反应在t1 min内的平均速率为v(H2)=
| ||
| B、保持其他条件不变,起始时间容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)=0.40mol | ||
| C、保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | ||
| D、温度升至800℃时,若上述反应平衡常数为0.64,则正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
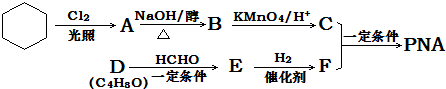
| KMnO4/H+ |
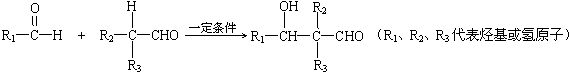
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com