
分析 (1)根据Ba(OH)2能与Na2CO3、CuSO4、NH4NO3、HCl来解答即可;
(2)根据物质按照组成物质的种类分成纯净物和混合物,纯净物按照元素种类分成单质和化合物,单质按照元素的性质分为金属、非金属.化合物分成氧化物、酸、碱、盐,氧化物按照组成元素不同分成金属氧化物和非金属氧化物,据此来分析即可.
解答 解:(1)甲中的Ba(OH)2能与Na2CO3、CuSO4、NH4NO3、HCl反应,
故答案为:Ba(OH)2;
(2)甲中的CO2、H2O、Fe2O3都是氧化物;而Ba(OH)2是碱;Na2CO3、CuSO4、NH4NO3都属于盐,HCl属于酸.
故答案为:Ba(OH)2、HCl.
点评 本题主要考查了物质的分类方法;解答时要分析物质的元素组成和物质组成,然后再根据各类物质概念的含义进行分析、判断,从而得出正确的结论.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 HCl | B. | ClO2 NaClO2 | C. | NaCl HClO | D. | KClO3 Ca(ClO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | W | G | H | P |
| 反应前质量/g | 20 | 2 | 1 | 37 |
| 反应后质量/g | a | 32 | 1 | 12 |
| A. | a=5 | B. | H一定是该反应的催化剂 | ||
| C. | 该反应是化合反应 | D. | 在反应中,G、P的质量比为8:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
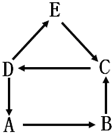 A、B、C、D、E为初中化学常见物质,A是单质,其余为化合物.E可用于检验气体B,它们之间有如图所示的转化关系(“→”表示生成,部分反应物、生成物、反应条件已省略).回答下列问题:
A、B、C、D、E为初中化学常见物质,A是单质,其余为化合物.E可用于检验气体B,它们之间有如图所示的转化关系(“→”表示生成,部分反应物、生成物、反应条件已省略).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A) | |
| B. | 等体积、等物质的量浓度的NaCl(aq) 微粒种类大于NaClO(aq)中微粒种类 | |
| C. | pH=3的硫酸溶液中水的电离程度大于pH=11的氨水溶液中水的电离程度 | |
| D. | 体积相同的0.1 mol/L氨水和0.1 mol/L NaOH溶液中和盐酸的能力后者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com