
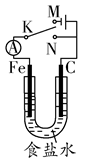
| A.若电键K与N连接,铁被保护不会腐蚀 |
| B.若电键K与N连接,正极反应式是4OH--4e-=2H2O+O2↑ |
| C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 |
| D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH |
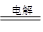 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑ 

科目:高中化学 来源:不详 题型:填空题
 2H2O设计成原电池。
2H2O设计成原电池。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.a电极是负极 |
| B.b电极上发生氧化反应 |
| C.该电池工作时化学能转化为电能 |
| D.该电池的总反应为2H2 + O2 = 2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
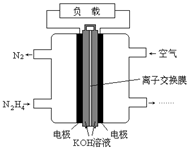
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.负极发生的电极反应式为:N2H4 + 4OH- - 4e - = N2+ 4H2O |
| C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
| D.该燃料电池持续放电时,正极发生氧化反应,PH减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | 可燃性气体 | 正极反应 | 负极反应 | 电池总反应 | pH变化 |
| (1) | H2 | | | | |
| (2) | CO | | | | |
| (3) | CH4 | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
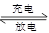 2CO32—+6H2O,则下列说法正确的是( )
2CO32—+6H2O,则下列说法正确的是( )| A.放电时CH3OH参与反应的电极为正极 |
| B.放电时负极的电极反应为CH3OH+8OH--6e-=CO32—+6H2O |
| C.标准状况下,通入5.6 L O2并完全反应后,有0.5 mol电子转移 |
| D.放电一段时间后,通入氧气的电极附近溶液的pH降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速率甲比乙慢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.微热 |
| B.加入适量氧化铜 |
| C.加入少量硫酸铜溶液 |
| D.加水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化铝膜破坏后,金属铝被迅速氧化 |
| B.白铁镀锌层破损后,还能阻止铁被氧化 |
| C.红热的铁与水接触表面上形成蓝黑色的保护层 |
| D.铁丝在氯气中燃烧产生大量棕黄色的烟 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com