
分析 (1)铜在空气中与O2、CO2、H2O反应产生Cu2(OH)2CO3;
(2)高温下CO具有强还原性,CuO被还原成Cu单质.
解答 解:(1)铜在潮湿的空气中会被锈蚀,生成绿色的碱式碳酸铜,是因为铜在空气中与O2、CO2、H2O反应产生Cu2(OH)2CO3;反应方程式为:2Cu+O2+H2O+CO2═Cu2(OH)2CO3,
故答案为:绿色;碱式碳酸铜;2Cu+O2+H2O+CO2═Cu2(OH)2CO3;
(2)高温下CO具有强还原性,黑色粉末CuO被还原成Cu单质,铜是红色固体,反应方程式为:CuO+CO$\frac{\underline{\;高温\;}}{\;}$Cu+CO2,
故答案为:黑色粉末变为红色固体;CuO+CO$\frac{\underline{\;高温\;}}{\;}$Cu+CO2.
点评 本题考查铜及其化合物的性质,属于基础知识的考查,注意碱式碳酸铜化学式的书写,题目比较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫离子:S-1 | |
| B. | 用电子式表示氯化氢分子的形成过程: | |
| C. | 氢氧根的电子式: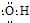 | |
| D. | HClO的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验操作 | 实验现象 | 实验结论 |
| 取反应后的溶液于试管中,加入碳酸钠溶液 | 紫色石蕊溶液变红色 | 丙同学的猜想正确 |
| 取反应后的溶液于试管中,硫酸铜溶液 | 有蓝色沉淀生成 | 你的猜想正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有AgBr沉淀 | |
| B. | AgCl和AgBr沉淀等量生成 | |
| C. | AgCl和AgBr沉淀都有,但以AgCl沉淀为主 | |
| D. | AgCl和AgBr沉淀都有,但以AgBr沉淀为主 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解.请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解.请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | a、b、c、d四点的Kw不同 | |
| C. | 在Fe(OH)3饱和溶液中加入适量硝酸钾晶体可使a点变到b点 | |
| D. | d点时的Cu(OH)2溶液为不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸 | B. | 稀NaOH溶液 | ||
| C. | FeCl3溶液 | D. | 酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;化合物ba3的结构式为
;化合物ba3的结构式为 .
. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com