
| A. | ②③⑥ | B. | ②④⑦ | C. | ①④⑤⑦ | D. | ③④⑥⑦ |
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [Cr(H2O)6]Cl3 | B. | [Cr(H2O)4Cl2]Cl•2H2O | ||
| C. | [Cr(H2O)5Cl]Cl2•H2O | D. | [Cr(H2O)3Cl3]•3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH | B. | C6H5-CH2-OH | C. | 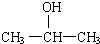 | D. | 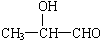 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液呈碱性 | |
| B. | C(Na+)+C(H+)=C(OH-)+C(CO32-)+C(HCO3-) | |
| C. | 溶液中存在两个水解平衡关系:CO32-+H2O?HCO3-+OH-(主要)HCO3-+H2O?H2CO3+OH-(次要) | |
| D. | 溶液中离子浓度大小关系为:C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数依次增加 | B. | 原子核外电子层数依次增加 | ||
| C. | 原子得电子能力逐渐减弱 | D. | 金属性逐渐增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com