
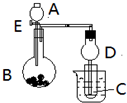
 用如图所示装置进行实验,将A逐滴加入B中:
用如图所示装置进行实验,将A逐滴加入B中:| 水浴加热 |
| 水浴加热 |


 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
| A、XY2 |
| B、X3Y |
| C、X2Y |
| D、XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
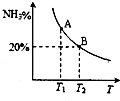 合成氨技术的发明使工业化人工固氮成为现实.
合成氨技术的发明使工业化人工固氮成为现实.| 温度/℃ CO2转化率%
|
100 | 150 | 200 | ||
| 1 | 19.6 | 27.1 | 36.6 | ||
| 1.5 | a | b | c | ||
| 2 | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:
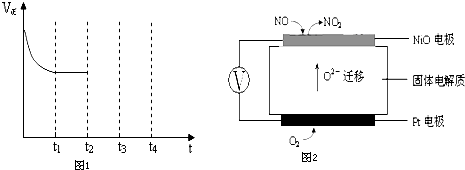
| 催化剂 |
投料比[
| 400K | 500K | 600K | ||
| 1 | 60% | 43% | 28% | ||
| 2 | 45% | 33% | 20% |
| n(NO2) |
| n(CH4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
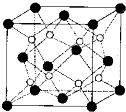 (1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未 成对的电子,w的原子序数为29.回答下列问题:
(1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未 成对的电子,w的原子序数为29.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ? | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com