
| |||||||||||||||||||
 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
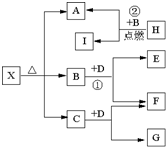 ����A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ�ص�ԭ���ǰ뾶��С��ԭ�ӣ�BԪ�ص�����������ˮ���������⻯�ﷴӦ����һ����X��D��Aͬ�壬����Eͬ���ڣ�EԪ�ص������������Ǵ�����������
����A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ�ص�ԭ���ǰ뾶��С��ԭ�ӣ�BԪ�ص�����������ˮ���������⻯�ﷴӦ����һ����X��D��Aͬ�壬����Eͬ���ڣ�EԪ�ص������������Ǵ�����������| 3 |
| 4 |
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��A��B��C��D����Ԫ�������ڱ��зֱ���Ԫ��X�����ܣ���ͼ������֪XԪ�����������Ļ�ѧʽΪX2O5��������Ԫ������һ��Ԫ�ص�ԭ�Ӱ뾶������������ͬ������С�ģ���ȷ����
��A��B��C��D����Ԫ�������ڱ��зֱ���Ԫ��X�����ܣ���ͼ������֪XԪ�����������Ļ�ѧʽΪX2O5��������Ԫ������һ��Ԫ�ص�ԭ�Ӱ뾶������������ͬ������С�ģ���ȷ����| c2(Fe2+)��c(I2) |
| c2(I-)��c2(Fe3+) |
| c2(Fe2+)��c(I2) |
| c2(I-)��c2(Fe3+) |
| c��I-����mol/L�� | c��Fe3+����mol/L�� | v[mol/��L?s��] | |
| ��1�� | 0.20 | 0.80 | 0.032K |
| ��2�� | 0.60 | 0.40 | 0.144K |
| ��3�� | 0.80 | 0.20 | 0.128K |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | He-268.8 | ��a��-249.5 | Ar-185.8 | Kr-151.7 |
| �� | F2 -187.0 | Cl2 -33.6 | ��b�� 58.7 | I2 184.0 |
| �� | ��c�� 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| �� | H2O 100.0 | H2S-60.0 | ��d��-42.0 | H2Te-1.8 |
| A��ϵ�Т����������ʵķе�������������Ϊ���Ӽ�Ļ�ѧ����ǿ |
| B��ϵ�Т����ʾ��������ԣ�ϵ�Т����ʶ�Ӧˮ��Һ����ǿ�� |
| C��ϵ�Т��и���������ȶ���˳��Ϊ��H2O��H2S��H2Se��H2Te |
| D���ϱ������ʣ�c����H2O����е���ͬϵ������������ڷ����ڴ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ����һ��ѧ��ר��1���۽ṹ�����ʵĶ����ԡ�1.2.2���ۼ������Ӽ�������(�ս̰����2) ���ͣ�022
������ͬ������ʣ����ǵķе�(p��1.01��105 Pa)�����ʾ��
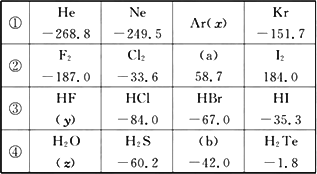
�Ը����ϱ��ش��������⣺
(1)�����£�aΪ________ɫҺ�壻b�ķ���ʽΪ��________��
(2)д����ϵ����������Ҫ��ѧ���ʵĵݱ����________(��дһ��)��
(3)������������⣬��������ϵ�������ʵķе�����Է�������֮�������һ���Ĺ�ϵ���ù�ϵ��________��
(4)�ϱ��У�________��________�������ʵķе��ͬϵ���������ʷ�������������Ҫԭ����________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com