
【题目】已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示,下列有关叙述中正确的是( )

A. 该反应的进行一定需要加热
B. 该反应的ΔH=-(E1-E2) kJ/mol
C. 该反应中反应物的键能总和大于生成物的键能总和
D. 断裂1 mol A—A键和2 mol B—B键放出E1 kJ能量
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;A、D同主族,D的焰色反应为黄色;E的简单阳离子与X具有相同电子数,且E是同周期中简单离子半径最小的元素;F元素的原子最外层比次外层少两个电子,C、G两种元素的原子最外层共有13个电子。则
(1)F在元素周期表中的位置为_______________。
(2)在2 L的密闭容器中,充入2 mol B2和3 mol A2,在一定条件下发生反应,5 s后测得A2为1.8 mol,则以B2的表示的反应速率v(B2)为__________________________。
(3)常温下,液态的B2A4与气态的BC2两者发生反应生成无毒物质,16g B2A4发生反应放热akJ,该反应的热化学方程式为_______________。
(4)D2F溶液在空气中长期放置发生反应,生成一种强碱与D2F2。D2F2与过氧化钠的结构和化学性质相似,其溶液显黄色。D2F2的电子式为_______,写出D2F在空气中长期放置生成D2F2的化学反应方程式为:_____________。D2F2的溶液与稀硫酸反应产生的现象为_____________。
(5)化学家发现一种化学式为A4B4的离子化合物,一定条件下1mol A4B4熔融电离生成两种离子各1mol,则该物质熔融时的电离方程式为____________。
(6)向30mL某浓度由A、B、C、D中三种元素形成一元强碱溶液通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。

则曲线Y表明M中的溶质为________;原NaOH溶液的物质的量浓度为_______;由曲线X、Y可知,两次实验通入的CO2的体积比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方式正确的是( )
A.CO2气体中含有的少量杂质SO2可通过饱和Na2CO3溶液除去
B.NaOH溶液中含有少量的Ba(OH)2可加入适量的Na2SO4过滤除去
C.K2CO3固体中含有少量的NaHCO3杂质可用加热的方式提纯
D.Cu粉中含有的少量杂质Fe可加入FeCl3溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象所得出的结论正确的是
选项 | 实验现象 | 实验结论 |
A | 将铝片分别投入浓、稀硝酸中,前者无明显现象,后者反应剧烈 | 稀硝酸的氧化性比浓硝酸的强 |
B | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
C | 某溶液中滴加过量氨水产生白色沉淀且不溶解 | 该溶液中一定含有Mg2+ |
D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有相同质量的两份NaHCO3粉末,第一份加入足量盐酸,第二份先加热使其完全分解再加足量同质量分数的盐酸,则两者所消耗的盐酸中氯化氢的质量比为( )
A.2:1
B.1:1
C.1:2
D.4:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 自然界中存在不需要活化能推动的反应
B. 催化剂同时改变正逆反应速率
C. 活化分子的每次碰撞都能发生反应
D. 活化能的作用在于使反应物活化,从而启动反应或改变反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化铜(II)甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
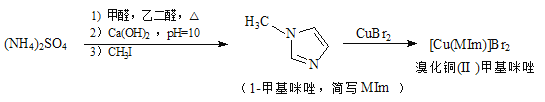
(1)铜元素位于周期表中第_____族,写出基态Cu2+的电子排布式_______。
(2)与NH4+互为等电子体的阴离子为_______。
(3)SO42-中心原子的杂化方式为_________。
(4)Mlm中含σ键与π数目之比为__________。
(5)一种铜的溴化物晶胞结构如下图所示。
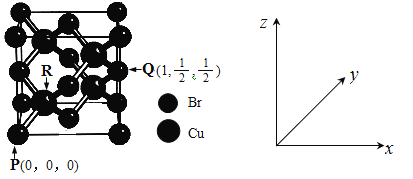
由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为______。

(6)Cu晶体的堆积方式如图所示,设Cu原子半径为a,晶体中Cu原子的配位数为____,晶体的空间利用率为__________。(列式计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,充入4mol气体A和2mol气体B发生反应:3A(g)+2B(g)![]() 4C(?)+2D(?).反应一段时间后达到平衡,测得生成1.6mol C,反应前后体系压强之比为5:4.则下列说法正确的是( )
4C(?)+2D(?).反应一段时间后达到平衡,测得生成1.6mol C,反应前后体系压强之比为5:4.则下列说法正确的是( )
A. 气体A的平衡转化率大于气体B的平衡转化率
B. 物质D的聚集状态一定是气体
C. 平衡后升高温度,若平衡向左移动,则正反应的△H>0
D. 平衡后若减小该体系的压强,则平衡向左移动,化学平衡常数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com