
【题目】对食物的酸、碱性判断正确的是( )
A. 西瓜是酸性食物 B. 猪肉、牛肉是碱性食物
C. 巧克力、奶油是酸性食物 D. 大米、面包是碱性食物
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
选项 | 碱 | 酸 | 盐 | 酸性氧化物 |
A | 苏打 | 硫酸 | 小苏打 | 二氧化硫 |
B | 苛性钠 | 碳酸 | 胆矾 | 一氧化氮 |
C | 烧碱 | 硝酸 | 石灰石 | 二氧化硅 |
D | 纯碱 | 醋酸 | 碘化钾 | 一氧化碳 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向平底烧瓶中放入氢氧化钡晶体[Ba(OH)2·8H2O]和氯化铵(NH4Cl)晶体,塞紧瓶塞。在瓶底和木板间滴少量水(如图所示)。

一段时间后,发现瓶内固态物质变稀,有液体生成,瓶壁变冷,小木板黏结在烧瓶底部。这时打开瓶塞,烧瓶中散发出刺鼻的气味,是因为发生了反应:Ba(OH)2·8H2O+2NH4Cl![]() BaCl2+2NH3↑+10H2O。下列有关该实验的结论正确的是
BaCl2+2NH3↑+10H2O。下列有关该实验的结论正确的是
A.自发反应一定是放热反应 B.自发反应一定是吸热反应
C.有的吸热反应也能自发进行 D.吸热反应不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是高中化学重点学习大三大气体之一,是常见的大气污染物之一,同时有是重要的工业原料,探究其制备方法和性质具有非常重要的意义,请回答下列问题。
Ⅰ.某研究小组将纯净的SO2气体通入0.5mol/L的Ba(NO3)2溶液中,得到了BaSO4沉淀。为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
(1)验证假设一
①请在下表空白处填写相关实验现象。
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ | 假设一成立 |
实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ |
②设计实验1的目的是_________。
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图甲所示。实验2中溶液pH小于实验1的原因是(用离子方程式表示)_________。
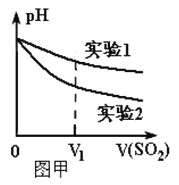
Ⅱ.我国规定空气中SO2含量不得超过0.02mg/L。某化学兴趣小组选用图乙实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。

(1)若原料气从左向右流时,上述装置连接的顺序是:原料气→______ (用字母和箭头表示)。当装置②中出现_______现象时,立即停止通气。
(2)你认为下列试剂中,可以用来代替试管中的酸性KMnO4溶液的是________。(填字母代号)
A.NaOH溶液 B.溴水 C.氨水 D.BaCl2溶液
Ⅲ.中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g/L。某兴趣小组用图丙装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行定性测定。
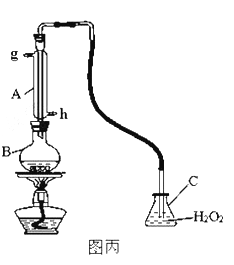
(1)B中加入250.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,除去C中过量的H2O2,然后用0.0900mol/L NaOH标准溶液进行滴定,滴定终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为_______g/L。
(2)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小刚同学探究二氧化硫分别与BaCl2溶液、Ba(OH)2溶液反应的实验。
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为
________________________________________________________________________,
过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为
________________________________________________________________________。
(2)请回答有关问题。小刚同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明
显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:
![]()
![]()
![]()
![]()
![]()
则操作①的名称为________,试剂A的化学式为________。
(3)实验表明,小刚加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是________(填化学式),产生该白色沉淀的离子方程式是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+c(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是()
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是()
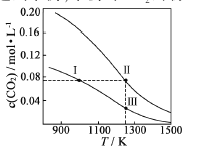
A. 反应CO2(g)+c(s)![]() 2CO(g)△S>0、△H<0
2CO(g)△S>0、△H<0
B. 体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ)
C. 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D. 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。这里用到的可用于分离的实验方法是
A. 萃取 B. 蒸馏 C. 过滤 D. 分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com